Рак желудка
Наиболее распространенный гистологический тип рака желудка — это аденокарцинома, которая в свою очередь имеет два подтипа: кишечный (интестинальный) и диффузный. Они различаются между собой локализацией, клиническими проявлениями и механизмами патогенеза. Кишечный тип спорадической аденокарциномы желудка развивается из нормального эпителия, который претерпевает ряд последовательных изменений: хронический атрофический гастрит (обычно Helicobacter pylori ассоциированный, но может быть и аутоиммунный), кишечная метаплазия, дисплазия и рак. Диффузный тип аденокарциномы желудка характеризуется более инвазивным и агрессивным течением, он имеет сходство с лобулярным (дольковым) типом рака молочный железы, а также может сопровождаться утратой Е-кадгерина.
Наследственная предрасположенность
Ряд исследований, проведенных в последние годы, показали наличие повышенного риска (до трехкратного) возникновения рака желудка у родственников пациентов с данным заболеванием. Исследования на монозиготных близнецах показали небольшую тенденцию к увеличению конкордантности развития рака желудка в сравнении с дизиготными близнецами. Случаи больших семей с аутосомно-доминантной, высокопенетрантной наследственной предрасположенностью к раку желудка крайне редки. Однако было показано, что раннее начало диффузного рака желудка часто ассоциировано с локусом 16q хромосомы, а именно с мутацией в гене E-кадгерин/CDH1. Это основополагающее открытие было подтверждено многими исследованиями, которые подчеркивали относительно высокий (67-83%) уровень пенетрантности данных аберраций. Фактически профилактическая гастрэктомия может быть показана в семьях с герминальной мутацией E-кадгерина даже при отсутствии грубых повреждений слизистой оболочки по результатам эндоскопического исследования желудка.
Синдром Линча характеризуется герминальными мутациями генов репарации ошибочно спаренных нуклеотидов ДНК («mismatch repair» MMR). Рак желудка может развиваться в некоторых семьях с синдромом Линча. Также данное заболевание можно встретить у пациентов с семейными аденоматозным полипозом или синдромом Пейтца-Егерса.
Роль Helicobacter pylori и других факторов окружающей среды
H. pylori в качестве комменсала распространен по всему миру. Несмотря на то, что Всемирная Организация Здравоохранения (ВОЗ) относит этот возбудитель к I классу карциногенов, H. Pylori обычно не приводит напрямую к развитию рака желудка. Это подчеркивает важность других факторов риска, таких как вирулентность, факторы окружающей среды и факторы самого организма человека: генетические полиморфизмы (например, интерлейкина-1β, ингибитора секреции соляной кислоты). Было обнаружено, что некоторые варианты аллелей гена муцина MUC1 могут быть ассоциированы с раком желудка. ДНК вируса Эпштейн-Барр (ВЭБ) также была обнаружена у пациентов с определенным типом рака желудка (лимфоэпителиальный тип), однако значимость этого феномена до сих пор неясна.
Механизмы молекулярной генетики
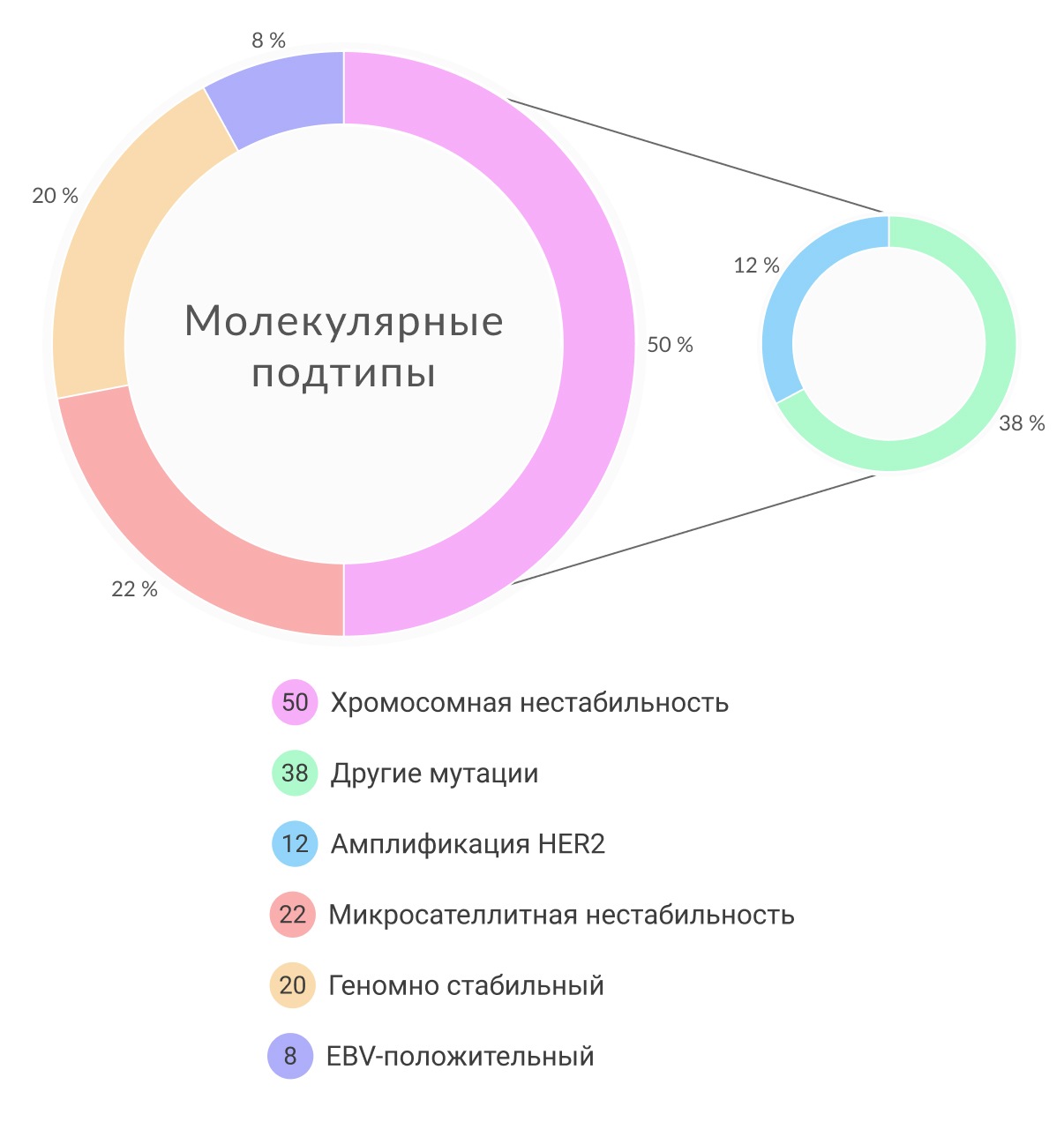
Первая попытка составить полную молекулярную классификацию рака желудка принадлежала сингапурским исследователям в 2013 году. Основываясь на экспрессионной карте, им удалось выделить три основные типа рака желудка (РЖ): пролиферативный (характеризуется высоким уровнем геномной нестабильности и мутацией TP53), метаболический (наиболее чувствительный к терапии 5-фторурацилом) и мезенхимальный тип (опухоли, подобные стволовым клеткам, чувствительны к ингибиторам сигнального пути PIK3CA-mTOR). В свою очередь ученые научной группы TCGA опубликовали классификацию рака желудка, где указано четыре основные подгруппы, основанные на шести различных методах молекулярной биологии: анализ вариации числа копий последовательности ДНК (copy number variation CNV), секвенирование экзома, анализ профиля метилирования ДНК, секвенирование мРНК, секвенирование микроРНК и анализ с помощью белковых чипов с обращенной фазой (reverse phase protein array). В результате было выделено 4 геномных подтипа РЖ: ВЭБ-позитивные раки (9% всех опухолей желудка с высокой частотой мутаций PIK3CA и гиперэкспрессией PD-L1/PD-L2), опухоли с микросателлитной нестабильностью (MSI, представляют 22% и относятся к гипермутированным опухолям), опухоли с хромосомной нестабильностью (CIN, составляют 50%, преобладают опухоли с локализацией в месте перехода пищевода в желудок, сопровождаются мутациями TP53 и активацией RTK-RAS, а также высоким уровнем CNV) и генетически-стабильные опухоли.
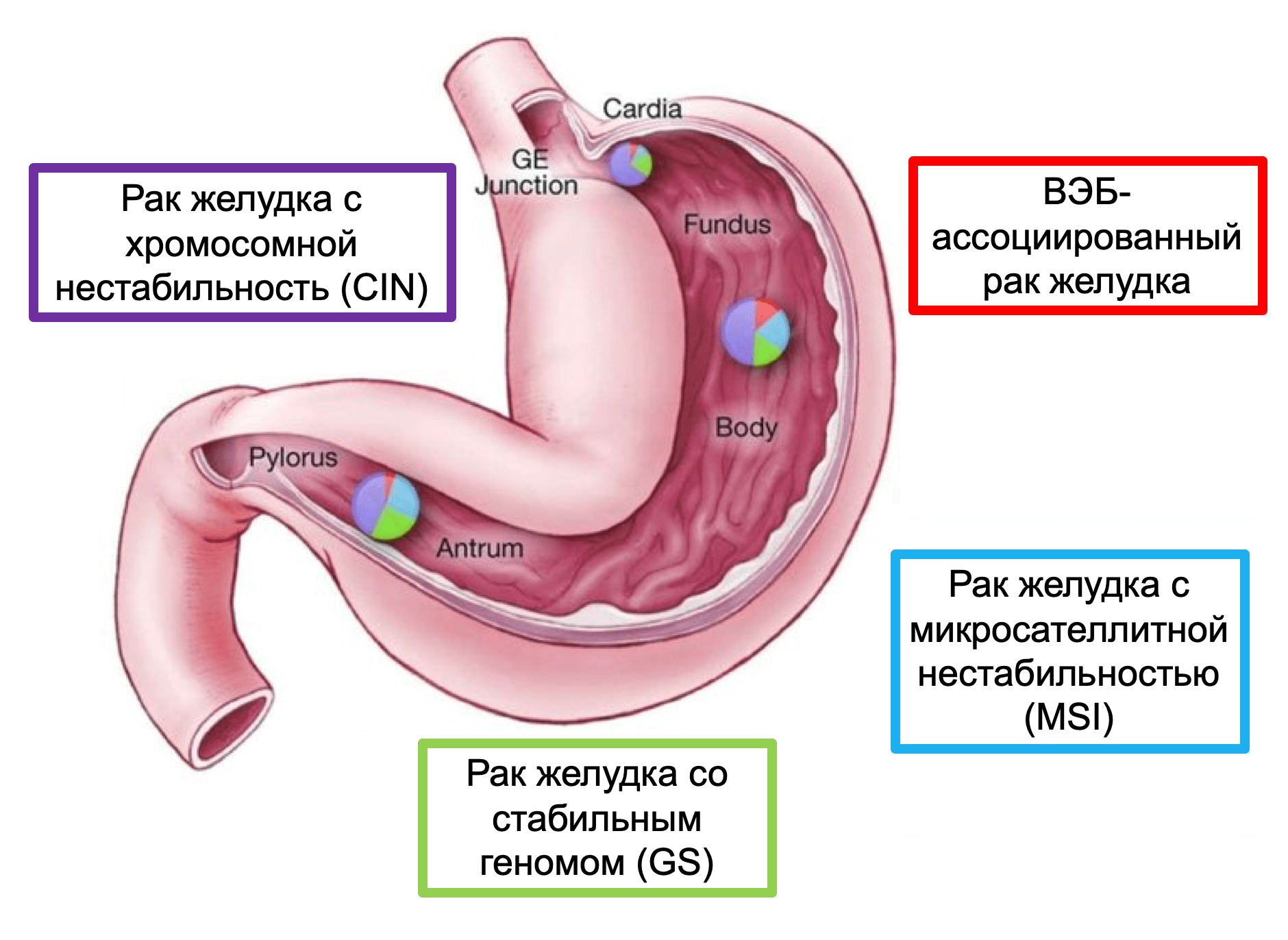
Рак желудка с хромосомной нестабильностью (CIN)
Подтип CIN составляет почти половину случаев РЖ и обычно развивается в месте перехода пищевода в желудок/кардиальном отделе желудка. Увеличение числа копий хромосом 8q, 17q и 20q при РЖ с CIN ассоциировано с гистологическим кишечным типом РЖ, тогда как увеличение копийности 12q и 13q хромосом чаще связано с РЖ диффузного типа. По данным TCGA, CIN обнаруживается с высокой частотой в области перехода пищевода в желудок/кардии (65%, P = 0.012). CIN характеризуется соматическими мутациями на цитогенетическом уровне, которые затрагивают локусы, отвечающие за контрольные точки митоза. Таким образом гены общего контроля и «гены-привратники» (gatekeeper) оказываются задействованными в канцерогенезе.

Для CIN типа РЖ характерно глобальное изменение копийности ряда генов, так и структурные аномалии в некоторых хромосомах. Такие изменения могут привести к увеличению или потере целых хромосом (анеуплоидия), нереципрокным транслокациям, амплификациям, делециям или потере одного аллеля с утратой гетерогенности. В целом, при CIN наблюдается потеря или усиление функции некоторых «ключевых генов» (к ним часто относятся онкогены и гены-супрессоры опухолей). Они могут быть использованы в качестве мишеней для специфической терапии молекулами-ингибиторами. Примечательно, что мутации в гене TP53 и тирозинкиназных рецепторах достаточно часто встречаются при РЖ с CIN, как и амплификация генов контроля клеточного цикла (циклин Е1, циклин D и циклин-зависимая киназа 6).
Изучение биологических характеристик опухолей с CIN позволило выявить мутации гена TP53 в 71% случаев РЖ. Также в CIN опухолях были выявлены амплификации в таких сигнальных путях, как RTK/RAS/MAPK, включая HER2, BRAF, эпидермальный фактор роста (EGFR), MET, FGFR2, RAS.
HER2
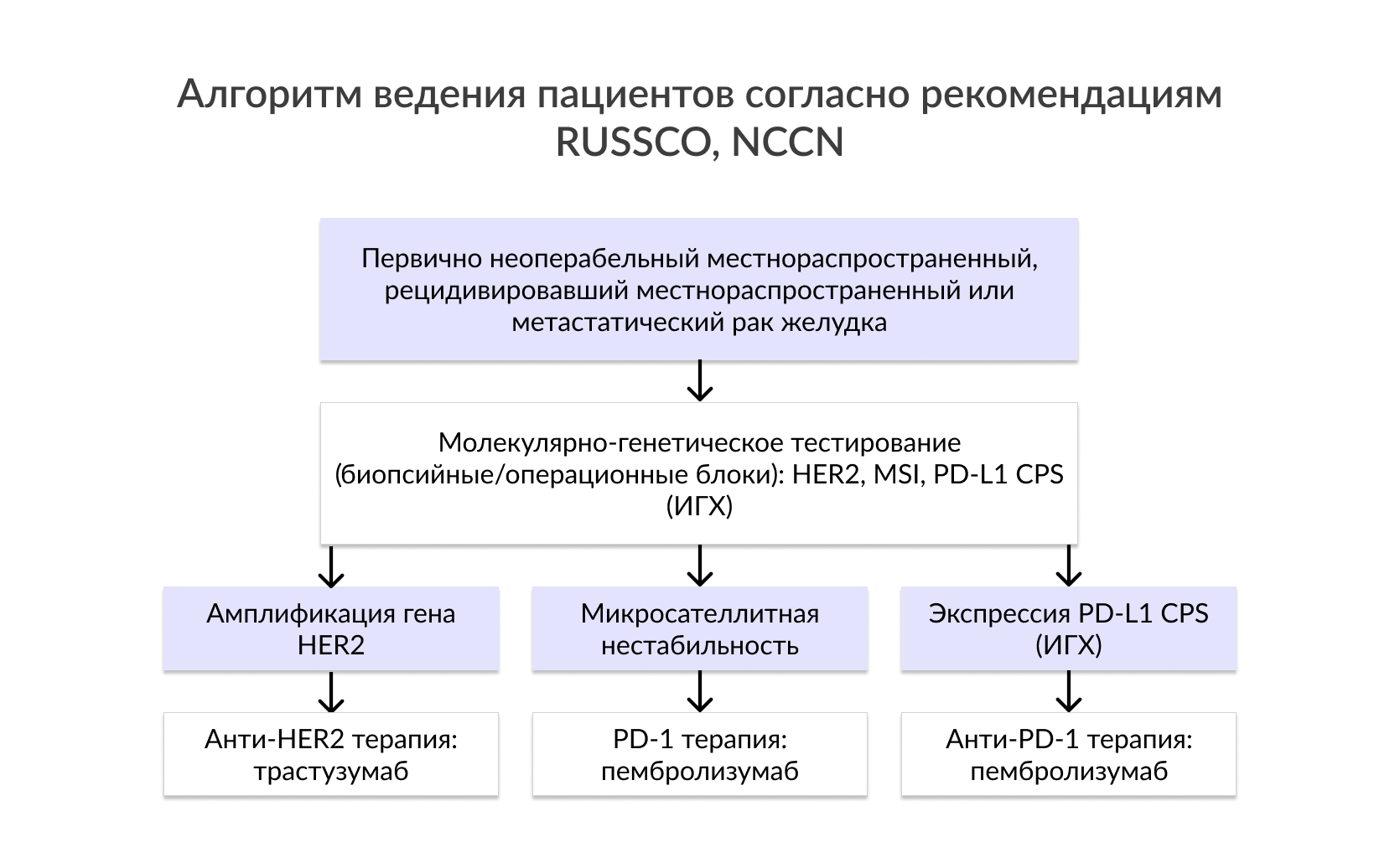
Протоонкоген HER2 является членом семейства рецепторов EGF с тирозинкиназной активностью. Известно, что результаты теста на HER2 могут быть вариабельны в зависимости от локализации первичного очага опухоли, а также гистологического типа РЖ. Гиперэкспрессия/амплификация HER2 обнаруживается в более чем 30% случаев опухолей, локализованных в месте перехода пищевода в желудок, в то время как опухоли тела желудка оказываются HER2-положительными менее чем в 20%. Кроме того, распространенность HER2 амплификации при кишечном и диффузном РЖ составляет 34% и 6%, соответственно. HER2 играет ключевую роль во множестве клеточных процессов, таких как дифференцировка, пролиферация и сигнальная трансдукция. Новым стандартом в лечении HER2-позитивных метастатических форм РЖ является комбинирование химиотерапии с препаратом таргетной терапии– трастузумабом. Другие HER2-ингибиторы в настоящее время проходят клинические испытания.
Микросателлитная нестабильность (microsatellite instability, MSI)
Согласно молекулярной классификации TCGA существует отдельная подгруппа РЖ с MSI. Микросателлитная нестабильность (MSI) встречается в 15%-30% случаев РЖ и наиболее часто коррелирует с кишечным типом, локализованным в дистальной части желудка. Пациентами с такими опухолями чаще являются женщины старшего возраста.
MSI – это генетическое изменение, характеризующиеся уменьшением или увеличением участков повторяющихся нуклеотидных последовательностей, называющихся микросателлитами. Эти изменения вызваны дисфункцией ферментов системы репарации ошибочно спаренных нуклеотидов (MMR), ввиду возникновения мутаций в одном или нескольких генах MMR (MLH1 или MSH2).
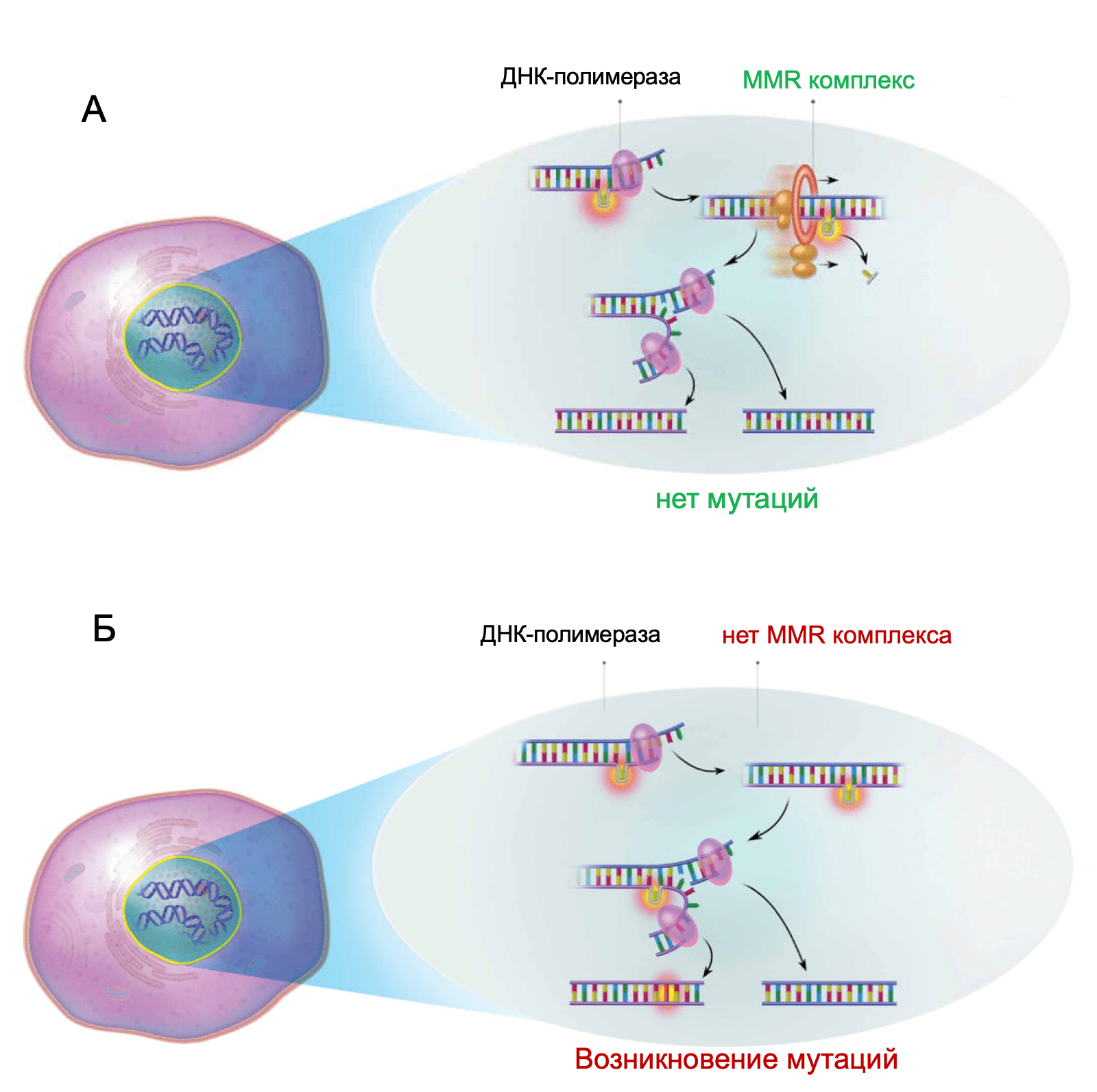
Дефекты в системе репарации ошибочно-спаренных нуклеотидов являются признаком синдрома Линча. Главным механизмом появления MSI при РЖ являются мутации широкого спектра различных генов системы MMR без гиперметилирования MLH1.
Так, пациенты с колоректальным раком с MSI имеет лучший прогноз в сравнении с пациентами с микросателлитной стабильностью (MSS) и не требует применения адьювантной химиотерапии фторпиримидином после резекции при второй стадии заболевания (при РЖ чаще применяют 5-фторурацил). Мета-анализ Zhu et al. показал снижение риска смертности на 37% и увеличение показателей выживаемости пациентов с MSI в сравнении с пациентами c MSS. Работа в рамках MRC MAGIC по исследованию взаимосвязи между дефицитом MMR, MSI и выживаемостью проводилась с участием пациентов с резектабельным РЖ и включала в себя 2 рандомизированные группы подхода к лечению: только хирургический метод в первой группе и периоперационная химиотерапия – во второй. На исключительно хирургическое лечение лучший ответ был получен у пациентов с дефицитом MSI и MLH1, в то время как химиотерапия показала негативный эффект в этой группе.
В случаях MSI обычно отсутствует амплификация генов, однако обнаруживаются мутации в генах PIK3CA, ERBB3, ERB22 и EGFR. Также, мутация BRAF V600E зачатую отсутствует при РЖ с MSI. Предиктивная роль этих мутаций при РЖ с MSI остается неясной.
Фактически, увеличение числа соматических мутаций может привести к амплификации синтеза неоантигенов, которые стимулируют иммунную систему и впоследствии увеличивают чувствительность опухоли к блокаде PD-1. Интересно, что в опухолях с MSI наблюдается тенденция к развитию лимфоцитарной инфильтрации, что похоже на иммунную активацию Т-клеток, направленных на опухолеспецифические пептиды, появившиейся в результате сдвига рамки считывания. Дополнительно, генетические аберрации в опухолевых клетках могут приводить к аберрантной экспрессии PD-L1, что обуславливает предиктивную значимость MSI.
РЖ со стабильным геномом (genomic stability- GS)
РЖ со стабильным геномом составляет 20% опухолей, проанализированных группой исследователей TCGA. Этот тип рака одинаково часто встречается среди мужчин и женщин. РЖ с GS высоко распространены при диффузном типе рака желудка (58% согласно классификации по Lauren) и при дискогезивной карциноме (58%). Четверть таких опухолей располагается в антральном отделе желудка, около 20% – в области перехода пищевода в желудок/кардиальном отделе и приблизительно 15% – в теле желудка/дне. Основными соматическими изменениями генома при РЖ являются изменения в генах CDH1, ARID1A и RHOA. Кроме того, при опухолях желудка со стабильным геномом были обнаружены межхромосомные транслокации (между CLDN18 и ARHGAP26).
CDH1
Ген CDH1 локализован на хромосоме 16q22 и кодирует Е-кадгерин, который принадлежит к кадгериновому суперсемейству кальций-зависимых молекул клеточной адгезии. Хорошо изучена роль Е-кадгерина в прогрессии опухолей эпителиального происхождения. Инактивирующие мутации в гене CDH1 часто обнаруживаются при РЖ, особенно при наследственном диффузном типе. Метилирование промотера CDH1 также нередко обнаруживается при спорадическом РЖ. В исследовании Li et al было показано, что при диффузном типе РЖ мутации в гене CDH1 ассоциированы с низкой выживаемостью пациентов вне зависимости от стадии заболевания. В исследовании TGCA Research Network соматические мутации в CDH1 часто встречались при РЖ со стабильным геномом (37% случаев). Прогностическая значимость, а также потенциальная роль CDH1 в качестве мишени для терапии РЖ остается не до конца изученной.
ARID1A
При ВЭБ-позитивном (вирус Эпштейна — Барр) подтипе РЖ были обнаружены инактивирующие мутации в гене ARID1A. Ген ARID1A находится на 1p35.3 хромосоме и кодирует интерактивный домен, богатый аденином и тимином и содержащий белок 1А, который принимает участие в ремоделировании хроматина, а также влияет на регуляторные клеточные процессы, включая репарацию ДНК, дифференцировку и онтогенез. В исследовании Wang et al показано, что снижение экспрессии ARID1A коррелирует со стадией и дифференцировкой опухоли, а также с низким уровнем выживаемости у пациентов с РЖ со стабильным геномом. Восстановление экспрессии в клетках РЖ привело к подавлению клеточной пролиферации, в то время как снижение экспрессии в клеточных линиях эпителия желудка значительно увеличило скорость роста клеток.
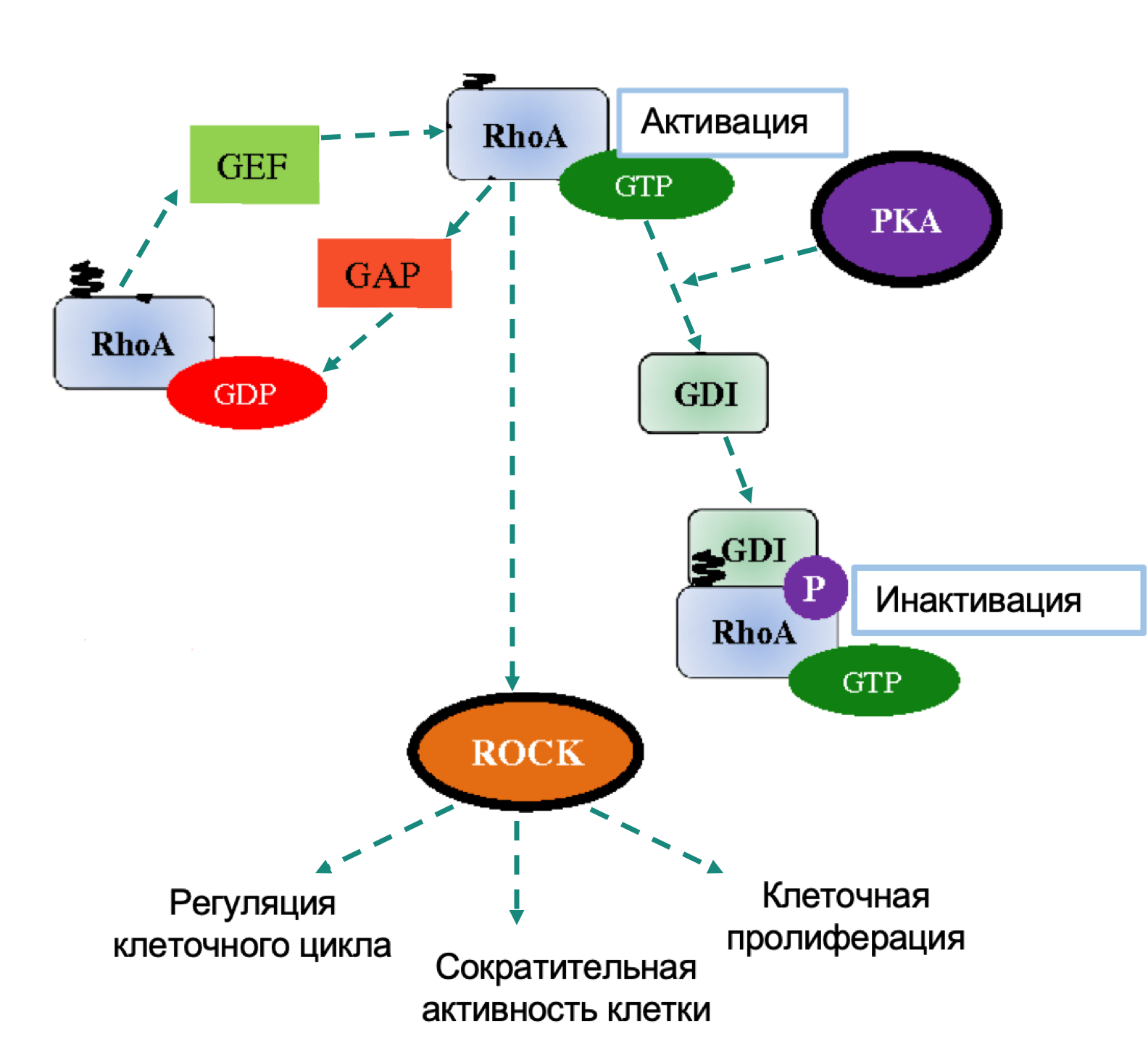
RHOA (Ras Homolog Family Member A)
Rho принадлежит к Ras-родственному семейству низкомолекулярных ГТФ-связывающих белков. Rho работает как переключатель между неактивной (связанной с ГДФ) и активной (связанной с ГТФ) формами. Он регулирует организацию цитоскелета, клеточную адгезию, транскрипцию, апоптоз и клеточный цикл, а также воздействует на туморогенез путем активации STAT3. RhoA играет роль в вышеперечисленных процессах через различные эффекторы: ROCK1, mDia и протеинкиназа N. Кроме того, путь Rho-ROCK участвует в Ras-опосредованной трансформации, амебовидном движении опухолевых клеток и миграции опухолевых клеток через мезотелиальный монослой. Согласно TCGA мутации RHOA сгруппированы в двух смежных аминокислотных областях, которые находятся на границе между RHOA и ROCK1 с другими эффекторами, отвечающими за передачу сигнала ниже. Диффузный тип РЖ, который характеризуется злокачественным фенотипом и стромальной дифференцировкой, часто сопровождается активирующими мутациями RHOA. Учитывая роль RHOA в формировании клеточной подвижности, его модуляция может влиять на увеличение паттернов роста и снижение клеточной адгезии, что является отличительными признаками диффузных опухолей.
ВЭБ-ассоциированный РЖ
Около 10% РЖ ассоциировано с латентно текущей инфекцией, вызванной ВЭБ, что было подтверждено с помощью in situ гибридизацией ВЭБ, полногеномного секвенирования или ПЦР. ВЭБ-ассоциированный РЖ имеет различные эпидемиологические и клинико-патологические особенности. Bae et al. провели метаанализ 39 исследований, где было выявлено 10-кратное (95%ДИ: 5.89-17.29) увеличение риска развития РЖ у пациентов с ВЭБ. В метаанализе, включавшим 70 исследований, общая распространенность ВЭБ-позитивных случаев РЖ в трех географических областях (Америка, Азия и Европа) составила 8,7% (95%ДИ: 7.5%-10.0%). Среди мужчин с ВЭБ, РЖ встречается в 2 раза чаще, чем среди женщин. Наиболее редко ВЭБ-ассоциированный РЖ располагается в антральном отделе желудка в сравнении с другими локализациями. Между кишечным и диффузным типами ВЭБ-ассоциированного РЖ не было выявлено статистической значимости (9.5%; 95%CI: 7.2%-12.5% и 7.6%; 95%CI: 5.7%-10.3% соответственно). Также было замечено, что среди молодых пациентов такой тип РЖ встречался чаще, чем среди более старшего населения.
Что касается подходов к терапии, в исследовании Kim et al показано, что у пациентов с ВЭБ-ассоциированным РЖ выявлен высокий уровень аберраций сигнальных путей, связанных с иммунным ответом, что может обуславливать благоприятный прогноз. По данным TCGA, ВЭБ-ассоциированный РЖ сопровождался увеличением копийности гена PD-L1, что подтверждает теорию о высокой иммуногенности данного заболевания. Основываясь на данных о том, что 15% ВЭБ-позитивных РЖ имели амплификацию в хромосомных областях 9p24.1 PD-L1 и PD-L2, было проведено исследование, посвящённое роли экспрессии PD-L1 в таких опухолях. Экспрессия PD-L1 встречалась в 50% исследуемых опухолей (16/32) и в 94% (30/32) иммунных клеток, инфильтрирующих опухоль. ВЭБ-негативные РЖ напротив показывают низкую экспрессию PD-L1 (10% и 39% среди иммунных клеток, инфильтрирующих опухоль, P <0.001).
Заключение
Молекулярно-генетические особенности РЖ до сих пор являются предметом активного изучения. В будущем молекулярно-генетические подтипы РЖ не только смогут помогать стратифицировать пациентов с РЖ по риску прогрессии и тяжести течения, но также назначать верную таргетную терапию и иммунотерапию.
| Молекулярное тестирование | Препараты, одобренные на территории РФ, а также используемые в рамках клинических исследований (*) |
| HER2 | Анти-HER2 антитела: трастузумаб |
| Микросателлитная нестабильность | Анти-PD-1 антитела: пембролизумаб |
| PD-L1 | Анти-PD-1 антитела: пембролизумаб |
Зеленый — чувствительность к терапии.
| Ген | Краткая информация |
| Амплификация гена HER2 | • Распространенность амплификации гена HER2 при раке желудка составляет около 10-12% (NCCN, 2020). |
| MSI | • MSI обнаруживается примерно в 10-22% случаев рака желудка. |
| Экспрессия мРНК PD-L1 | • Терапия ингибиторами контрольных точек иммунитета оказывается неэффективным во всех случаях низкой экспрессии PD-L1 (<1%). |
Список литературы
- DeVita, Vincent T., Jr., Theodore S. Lawrence, and Steven A. Rosenberg. Devita, Hellman, and Rosenberg’s Cancer: Principles & Practice of Oncology. 11th edition. Philadelphia: Wolters Kluwer, 2019.
- Network NCC. NCCN Clinical Practice Guidelines in Oncology Gastric cancer. 2020. doi:10.1016/b978-0-12-811785-9.00017-x.
- Cho J, Chang YH, Heo YJ, Kim S, Kim NKD, Park JO, et al. Four distinct immune microenvironment subtypes in gastric adenocarcinoma with special reference to microsatellite instability. ESMO Open 2018. doi:10.1136/esmoopen-2018-000326.
- Garattini SK, Basile D, Cattaneo M, Fanotto V, Ongaro E, Bonotto M, et al. Molecular classifications of gastric cancers: Novel insights and possible future applications. World J Gastrointest Oncol 2017. doi:10.4251/wjgo.v9.i5.194.
- Sanjeevaiah A, Cheedella N, Hester C, Porembka MR. Gastric Cancer: Recent Molecular Classification Advances, Racial Disparity, and Management Implications. J Oncol Pract 2018. doi:10.1200/jop.17.00025.
- Ye DM, Xu G, Ma W, Li Y, Luo W, Xiao Y, et al. Significant function and research progress of biomarkers in gastric cancer (Review). Oncol Lett 2020. doi:10.3892/ol.2019.11078.
- Maleki SS, Röcken C. Chromosomal Instability in Gastric Cancer Biology. Neoplasia (United States) 2017. doi:10.1016/j.neo.2017.02.012.