Рак молочной железы
Рак молочной железы этиологически представляет собой гетерогенное онкологическое заболевание, обусловленное постепенным накоплением генетических аберраций, включая точечные мутации, хромосомные амплификации, делеции, перестройки, транслокации и дупликации. Подавляющее большинство злокачественных новообразований молочной железы возникают спорадически и связаны с соматическими мутациями. Герминативные мутации ассоциированы с 10% случаев рака молочной железы и встречаются в рамках нескольких наследственных синдромов.
Наследственный рак молочной железы
Отягощенный семейный анамнез является одним из важнейших факторов риска развития рака молочной железы. Несмотря на то, что семейные формы составляют около 20% злокачественных новообразований, многие гены, ответственные за их развитие, в настоящее время не до конца изучены. В целом, гены, мутации в которых ассоциированы с раком молочной железы, можно разделить на 3 группы в зависимости от распространенности и степени ассоциированного риска: редкие гены с высокой пенетрантностью, редкие гены с умеренной пенетрантностью, распространенные гены и локусы с низкой пенетрантностью.
Высокопенетрантные, редко встречающиеся гены BRCA1 и BRCA2
Мутации в генах BRCA1 и BRCA2 ответственны почти за половину доминантно наследуемых случаев рака молочной железы. Присутствие данных мутаций повышает риск развития злокачественного новообразования в 10-30 раз и приводит к 85% риску развития рака молочной железы в течение жизни. В целом, дефекты BRCA1 и BRCA2 не очень распространены среди населения, однако частота их встречаемости выше среди некоторых этнических групп, прежде всего у евреев Ашкенази, среди которых частота носительства составляет 1:40.
В генах BRCA1 и BRCA2 было выявлено более тысячи герминативных мутаций. Патогенные мутации часто приводят к формированию укороченной формы белка, а также могут нарушать его функцию. Следует отметить, что пенетрантность патогенных мутаций в генах BRCA1 и BRCA2 и возраст развития рака у пациентов значительно варьируют.
Особенности BRCA1-ассоциированного рака молочной железы позволяют отличать его от BRCA2-ассоциированных и спорадических злокачественных новообразований. Так, он чаще поражает молодых женщин и характеризуется более агрессивным течением, что включает низкую степень дифференцировки, высокий уровень пролиферативной активности, отсутствие рецепторов эстрогена (ER), прогестерона (PR) и эпидермального фактора роста 2 (HER2). Данный трижды негативный фенотип BRCA1-ассоциированного рака также характеризуется базальноподобной экспрессией генов цитокератинов 5/6, 14 и 17, эпидермального фактора роста и P-кадгерина. Несмотря на то, что гены BRCA1 и BRCA2 в норме кодируют белки с большим количеством функций, они прежде всего выступают в качестве типичных генов-супрессоров, обеспечивая генетическую стабильность путем репарации ДНК методом гомологичной рекомбинации. При утрате гетерозиготности (LOH), происходящей вследствие потери, мутации или подавления «дикого типа» BRCA1 и BRCA2, нарушается репарация ДНК, что приводит к накоплению дополнительных мутаций в ходе репликации ДНК и служит предпосылкой развития рака.
Неотъемлемая роль BRCA1 и BRCA2 в репарации двуцепочечной ДНК обуславливают интерес к ним как к возможной мишени терапии BRCA-положительного рака молочной железы. Например, препараты платины вызывают образование межцепочечных сшивок, блокируя репликацию ДНК и приводя к остановке вилки репликации. Ингибиторы поли(АДФ-рибоза)-полимеразы 1 (PARP1) также могут рассматриваться в качестве препаратов специфической терапии BRCA-положительных опухолей. PARP1 является ферментом, участвующим в репарации одноцепочечной ДНК путем удаления азотистых оснований, и служит главным альтернативным клеточным путем репарации ДНК. При подавлении данного пути в злокачественных опухолях с дефектами репарации двуцепочечной ДНК, как в случае BRCA-ассоциированных новообразований, клетки остаются без адекватных путей репарации ДНК, что приводит к остановке клеточного цикла, хромосомной нестабильности и гибели. Спорадически возникающие базальноподобные опухоли фенотипически напоминают BRCA1-положительный рак молочной железы и могут быть чувствительны к ингибиторам PARP1. Олапариб – первый в классе ингибитор PARP1 – недавно был одобрен FDA для лечения пациентов с герминативным BRCA-положительным HER2-негативным метастатическим раком молочной железы.
Другие выскокопенетрантные гены
Существуют и другие, редко встречающиеся гены, ассоциированные с высоким риском развития рака молочной железы. Так, к ним относят TP53, PTEN, STK11/ LKB1, и CDH1. Наличие мутаций в этих генах увеличивает риск развития рака молочной железы в 8-10 раз, однако они встречаются лишь в 1% злокачественных опухолей молочной железы. Как и BRCA1/BRCA2, данные гены функционируют как супрессоры и наследуются аутосомно-доминантно.
Умеренно пенетрантные, редко встречающиеся гены
Идентифицированы четыре гена, ассоциированные с умеренным повышением риска развития рака молочной железы: CHEK2, ATM, BRIP1 и PALB2. У носителей мутаций в этих генах риск рака молочной железы выше в 2-3 раза, однако этот показатель может быть выше при определенных клинических условиях. Мутации редко встречаются в популяции (0,1-1%), но в некоторых местах обнаруживаются чаще вследствие «эффекта основателя». В совокупности, дефекты этих генов отмечаются в 2,3% случаев наследственных раков молочной железы. Умеренный риск развития злокачественных новообразований молочной железы наряду с низкой распространенностью среди населения делает эти мутации трудно выявляемыми в рамках GWAS исследований. Указанные гены рассматриваются как кандидатные гены рака молочной железы прежде всего благодаря их роли в передаче сигнала и репарации ДНК по аналогии с BRCA1 и BRCA2.
Низкопенетрантные, часто встречающиеся гены и локусы
Полигеномный поиск ассоциаций и поиск ассоциаций среди кандидатных генов способствовали идентификации 10 различных аллелей и локусов, ассоциированных с низкой степенью повышения риска развития рака молочной железы и встречающихся у 15-40% пациенток. Несмотря на высокую распространенность, наличие только одной из этих аллелей минимально (примерно в 1,5 раза) повышает риск развития рака молочной железы. Тем не менее, их обнаружение может приобретать клиническое значение при наличии генов, ассоциированных с высокой, умеренной или низкой степенью повышения риска. Этот добавочный или мультипликативный риск может присутствовать у значительной части населения. Например, исследования мутаций генов рецептора фактора роста фибробластов 2 (FGFR2) и митоген-активируемой белковой киназы киназы киназы 1 (MAP3K1) у семей с носительством BRCA продемонстрировали, что наличие этих полиморфизмов увеличивает риск присутствия мутаций BRCA2.
Микросателлитная нестабильность при раке молочной железы
Новые данные демонстрируют, что синдром Линча, аутосомно-доминантное наследственное заболевание, предрасполагающее к развитию ряда злокачественных новообразований и вызываемое герминативными мутациями в генах системы репарации ошибочно спаренных нуклеотидов (MMR), таких как MLH1, MSH2, MSH6, и PMS2, может быть ассоциирован с повышенным риском рака молочной железы. У носителей мутаций отмечается предрасположенность к возникновению колоректального рака и других видов злокачественных опухолей, однако связь с раком молочной железы в настоящее время находится под вопросом. Проспективное когортное исследование с использованием регистра наследственного колоректального рака выявило риски рака среди здоровых носителей и членов семьи без мутации: примечательно, что риск развития рака молочной железы был в четыре раза выше у носителей мутации по сравнению с общепопуляционным. Систематический обзор по оценке риска рака молочной железы у носителей герминативных мутаций в генах системы MMR продемонстрировал смешанные результаты: в 13 исследованиях не отмечался повышенный риск, тогда как в 8 наблюдалось его увеличение в 2-18 раз. Таким образом, для более точной оценки возможной связи рака молочной железы с синдромом Линча необходимы дополнительные исследования с более длительным периодом наблюдения. Подобные работы могут повлиять на рекомендации по скринингу рака молочной железы у данной группы пациентов.
Соматические мутации и рак молочной железы
Большинство случаев рака молочной железы возникают спорадически, что связано с накоплением множества соматических мутаций. Согласно последним данным, типичная опухоль молочной железы содержит от 50 до 80 различных мутаций. Многие из них возникают в результате ошибок репликации ДНК, другие являются следствием влияния экзогенных и эндогенных мутагенов. В настоящее время сотни кандидатных генов рака молочной железы были выявлены в ходе полигеномного поиска ассоциаций и полноэкзомного секвенирования.
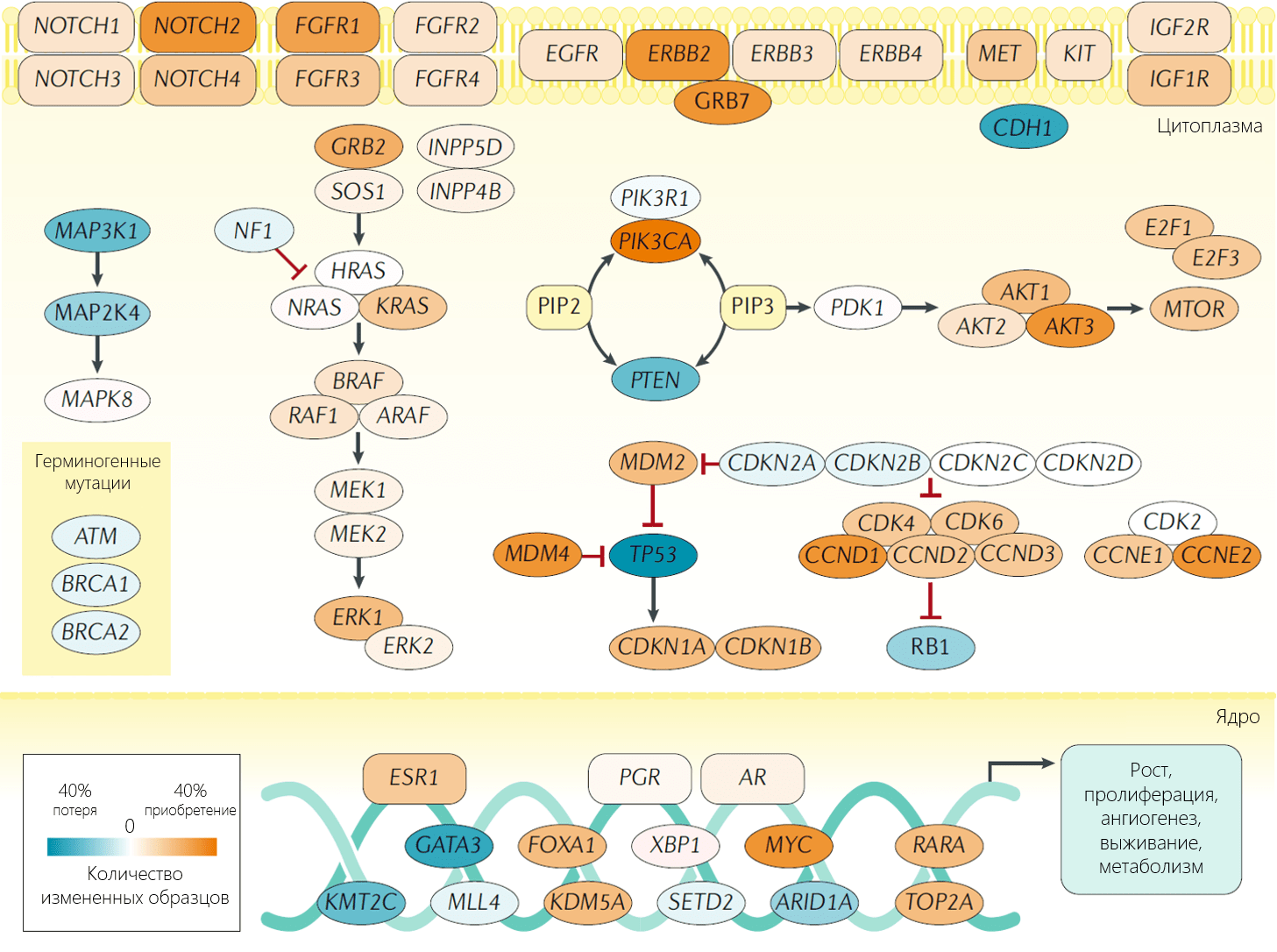
Тем не менее, определение роли каждой выявленной мутаций в развитии рака молочной железы остается сложной задачей. Предполагается, что многие из этих соматических аберраций являются мутациями-«пассажирами» — безвредными, биологическими нейтральными изменениями, не участвующими в процессе онкогенеза. Драйверные мутации, в отличие от них, играют роль в стимуляции роста клетки и могут приводить к развитию опухоли. Когда удается выявить все драйверные мутации, вырисовывается бимодальный генетический «ландшафт», в котором отмечаются «горы», часто встречающиеся мутации, среди небольших «холмов», редко наблюдаемые мутации. К часто встречаемым относят мутации в генах TP53, CDH1, фосфатидилинозитол-3-киназы (PI3K), циклина D, PTEN и AKT. Мутации, составляющие генетические «холмы», встречаются лишь в 5% случаев раков молочной железы. Эта выраженная гетерогенность мутаций ДНК при раке молочной железы может объяснять большое разнообразие фенотипов, включая фенотип опухоли и ее ответ на терапию.
Исторически исследования были сфокусированы на изучении генетических «гор», однако последние данные демонстрируют, что генетические «холмы» играют более значимую роль в развитии рака молочной железы. Это мнение основано на идее, что наличие множества мутаций, каждая из которых приводит к небольшому преимуществу в выживании, запускает прогрессию опухоли. Дальнейшие исследования показали, что значительное число этих редких соматических мутаций относятся к биологическим группам и путям внутриклеточной передачи сигнала, дефект которых часто отмечается при раке молочной железы. В качестве примера можно привести сигнальный путь интерферона, контрольные точки клеточного цикла, BRCA1/2-зависимую репарацию ДНК, p53, AKT, сигнальный путь трансформирующего фактора роста β (TGF-β), cигнальный путь Notch, рецептор эпидермального фактора роста (EGFR), фактор роста фибробластов (FGF), сигнальные пути ERBB2, RAS и PI3K. В целом, можно сказать, что в онкогенезе рака молочной железы значимыми являются скорее дефекты определенных сигнальных путей, нежели мутации конкретных генов.
Изменение числа копий гена при раке молочной железы
Несмотря на то, что рекуррентные точечные мутации при раке молочной железы встречаются реже, чем при других солидных опухолях, очевидно, что определенные участки генома часто амплифицированы в злокачественных новообразованиях молочной железы, и эти участки содержат гены, запускающие прогрессию рака. Наиболее изучен локус 17q12, содержащий онкоген HER2. Амплификация этого локуса ассоциирована с более агрессивным фенотипом опухоли, однако к данному фенотипу разработан эффективный таргетный препарат трастузумаб, представляющий собой моноклональное антитело. Показано, что подавление амплифицированных генов в локусе 17q12 путем РНК-интерференции приводит к снижению уровня клеточной пролиферации и ускорению апоптоза, что предполагает роль этих генов в онкогенезе. Кроме того, известны другие локусы, возможно имеющие прогностическое значение при раке молочной железы, включая 11q13 (CCDN1), 8q24 (MYC), 7p12 (EGFR), 20q13 (ZNF217) и прочие. Структурный анализ количественного изменения этих локусов, обнаруженных при раке молочной железы, показал, что все эти вариации обуславливают приобретение и потерю различных генов, которые одновременно запускают несколько онкогенных путей, и что данные онкогены сохраняются в ходе эволюции рака. Эти регионы содержат гены, участвующие в метаболизме ДНК и сохранении хромосомной целостности, что служит основанием предполагать, что ответ на ДНК-повреждающие агенты, которыми являются противоопухолевые препараты, может зависеть от наличия амплификации данных регионов. Так, данные ко-амплификации часто встречаются в HER2-амплифицированных опухолях и могут влиять на поведение опухоли и прогноз у пациента. Кроме того, отмечено, что отдельные варианты изменения числа копий ДНК ассоциированы с разными клинико-патологическими особенностями и подтипами экспрессии генов, что позволяет предположить, что в патогенезе этих подтипов рака молочной железы участвуют различные механизмы геномной нестабильности.
Транскрипционные профили рака молочной железы – молекулярные подтипы
Описанные выше изменения ДНК приводят либо к сниженной, либо к избыточной экспрессии соответствующих матричных РНК, следовательно, аномальный характер экспрессии генов часто отмечается в злокачественных клетках опухолей молочной железы. Было продемонстрировано, что оценка экспрессии множества генов в образце опухоли может помочь прогнозировать ее поведение. Так называемые «молекулярные автографы» в дальнейшем могут способствовать правильной диагностике, прогнозированию риска рецидива, выбору терапии у конкретных пациентов.
Для определения «молекулярного автографа» применяется множество технологий, включая ДНК-чипы и однонуклеотидные чипы, секвенирование РНК, полимеразную цепную реакцию (ПЦР) и новые методы ДНК баркодирования (например, Наностринг). Эти технологии в совокупности с недавно разработанными статистическими методологиями позволяют определять экспрессию от нескольких сотен до нескольких тысяч мРНК в образце ткани с последующим анализом характера экспрессии, определяющего возможность прогнозировать поведение опухоли.
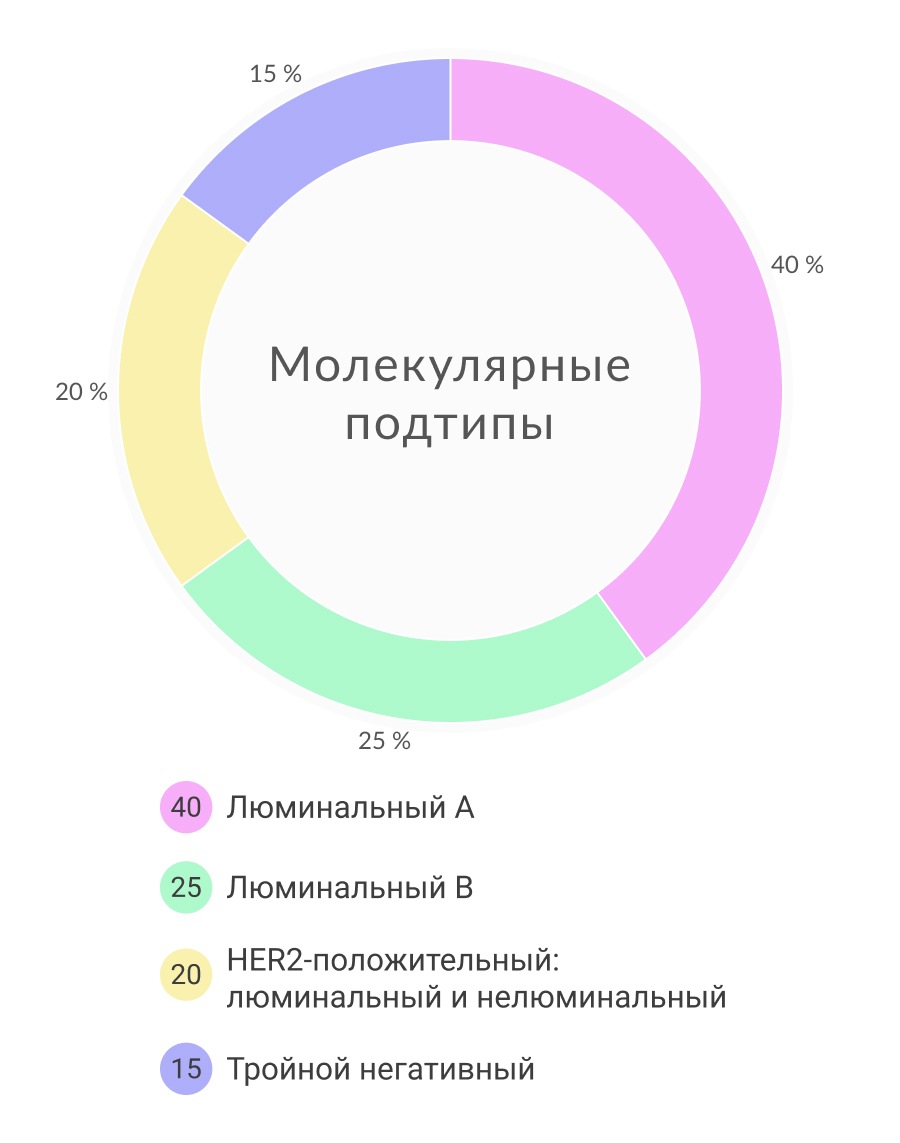
В исследованиях Perou et al. и Sørlie et al. предлагается классификация рака молочной железы на подтипы в зависимости от характера генетической экспрессии, именуемого «молекулярным портретом» рака молочной железы. Выделяются следующие категории опухолей: люминальные А и В (обычно ER- и/или PR-позитивные), HER2-положительные (гиперэкспрессирующие HER2), базальноподобные (экспрессируют базальные кератины). Исследовательские группы проекта «Атлас ракового генома» (TCGA) и Международного консорциума молекулярной таксономии рака молочной железы (METABRIC) подтвердили данную классификацию и дополнили «молекулярные портреты».

Люминальный подтип
Опухоли люминального подтипа составляют большинство злокачественных новообразований молочной железы и экспрессируют гены, типично экспрессируемые в люминальном эпителии молочной железы (такие как цитокератины 8 и 18, эстрогеновый рецептор 1 (ESR1), GATA3, FOXA1, XPB1 и MYB). Опухоли люминального подтипа разделяют на 2 подгруппы: А и В. Люминальный А подтип встречается чаще и характеризуется высоким уровнем экспрессии генов эстрогеновых рецепторов и низкой экспрессией кластера HER2, а также генов, ассоциированных с пролиферацией. При люминальном В подтипе, напротив, отмечается сниженная экспрессия генов эстрогеновых рецепторов, вариабельная экспрессия белка HER2 и высокий уровень экспрессии генов, ассоциированных с пролиферацией. В целом, опухоли люминального А подтипа имеют лучший прогноз, чем люминального В подтипа.
HER2-положительный подтип
На HER2-положительные опухоли приходится 10-15% всех случаев рака молочной железы. Для них характерна избыточная экспрессия HER2 и генов, ассоциированных с пролиферацией, а также сниженная экспрессия генов эстрогеновых рецепторов. Любопытно, что исследование, проведенное группой проекта «Атлас ракового генома», показывает, что не все опухоли, клинически характеризуемые как HER2-положительные, являются таковыми по молекулярной структуре согласно данным иммуногистохимии (ИГХ) и флуоресцентной гибридизации in situ (FISH), и наоборот. Большинство клинически HER2-положительных опухолей, генетически не относящимся к HER2-позитивным, принадлежат к люминальному В подтипу. Генетически HER2-позитивные опухоли не экспрессируют рецепторы к эстрогену и прогестерону.
Трижды негативный подтип
ER-негативные опухоли представляют собой гетерогенную группу, именуемую «трижды негативный рак молочной железы», поскольку они не экспрессируют ER, PR и HER2. Базальноподобная категория ER-негативной подгруппы, впервые обнаруженная с помощью технологии микрочипов первого поколения, характеризуется высоким уровнем экспрессии генов пролиферации и базальных цитокератинов 8, 23 и потерей экспрессии генов, ассоциированных с контролем клеточного цикла. Несмотря на то, что базальноподобные опухоли являются самым распространенным вариантом ER-негативных новообразований (50-75%) и составляют от 15 до 20% всех случаев рака молочной железы, существуют другие варианты ER-негативных опухолей: низко-клаудиновая группа, богатая интерферонами группа, группа, экспрессирующая рецепторы андрогена, нормо-подобная группа. Так, хотя низко-клаудиновая группа имеет некоторую схожесть с базальноподобным раком, эти опухоли отличаются низкой экспрессией клаудина, участвующего в образовании плотных контактов между эпителиальными клетками, а также характеризуются наличием черт стволовых клеток со способностью к эпителиально-мезенхимальному переходу. Кроме того, они имеют черты клеток врожденного и адаптивного иммунитета, однако последние исследования показывают, что данные опухоли резистентны к терапии ингибиторами контрольных точек иммунитета вследствие рекрутинга Т-регуляторных лимфоцитов в опухолевое микроокружение. В других работах предпринимались попытки характеристики трижды негативного рака молочной железы с помощью транскрипционного профилирования. Так, в работе Lehman et al было идентифицировано 6 различных подтипов: 2 базальноподобных, иммуномодулирующий, мезенхимальный, мезенхимальный с чертами стволовых клеток, люминальный подтип с рецепторами андрогена. Все подтипы имели разный ответ на терапию.
Несмотря на то, что точное определение молекулярных подтипов в настоящее время является предметом активных споров, очевидно, что их выделение воспроизводится в ходе множественных, не связанных друг с другом исследований, где также доказывается их прогностическое значение. Вследствие этого, теперь при проведении клинических исследований пациентов разделяют на группы в зависимости от их ER, PR, HER2-статуса, чтобы оценить эффективность разрабатываемой терапии прицельно для каждой их этих групп. В 2011 году, на международной конференции по раку молочной железы St. Gallen International Breast Cancer Conference было установлено, что рак молочной железы не должен лечиться как единое заболевание, а также было рекомендовано определение молекулярного подтипа в зависимости от ER, PR и HER2-статуса в совокупности с маркерами пролиферации, такими как Ki-67. Этот подход в настоящее время признается международным сообществом как оптимальный метод стратификации пациентов для назначения терапии.
Генетические и эпигенетические аномалии выражаются, в большинстве случаев, в ненормальных уровнях, функциях, взаимодействиях белков и сигнальных путей. Последние исследования генома позволили сформировать новое понимание протеома, ассоциированного со специфическими подтипами рака молочной железы, а также предложить новые мишени для терапии в дополнении к привычным агентам к ER и HER2. Без сомнений, для формирования злокачественного фенотипа требуется совпадение множественных альтераций, тем не менее, были выделены ключевые белки и их сигнальные пути, которые служат решающими драйверами развития рака молочной железы, которые также являются потенциальными мишенями терапии.
Молекулярные изменения сигнальных путей при раке молочной железы
Сигнальный путь рецептора эстрогена
Развитие большинства злокачественных опухолей молочной железы связано с воздействием эстрогена и изменениями в сигнальном пути эстрогенового рецептора. Эстроген – это стероидный гормон, который оказывает влияние путем связывания с ядерным рецептором эстрогена (ER). При взаимодействии с лигандом, рецептор эстрогена с помощью корегуляторных белков связывается с эстрогеновыми ответными элементами в промоутерном регионе целевых генов. Это приводит к транскрипции множества генов, отвечающих за клеточный рост, включая PR. Уровень экспрессии ER представляет собой не только биологический интерес, но также служит предиктором ответа на терапию анти-эстрогенами, которые рекомендованы при всех ER-экспрессирующих опухолях.
Несмотря на то, что в 70% инвазивных раков молочной железы отмечается избыточная экспрессия ER, точный механизм, согласно которому это происходит, неизвестен. Возможной причиной служит амплификация гена (около 50% случаев избыточной экспрессии ER в одном исследовании), однако нарушение регуляции транскрипции и посттрансляционные изменения (такие как изменение уровня мРНК под влиянием микроРНК) могут также играть роль. Кроме того, исследования показывают, что мутации ER могут приводить к постоянной активации этого сигнального пути и служить причиной резистентности к терапии антиэстрогенами.
Эстроген оказывает влияние через геномный (описан выше) и негеномный пути. В отличие от геномного пути, негеномные эффекты развиваются стремительно: от нескольких секунд до пары минут от воздействия эстрогена, и предположительно связаны с гормон-зависимой активацией мембранных и цитоплазматических эстрогеновых рецепторов. Эти внеядерные взаимодействия с рецепторами приводят к быстрому фосфорилированию и активации киназ, участвующих в регуляции клеточного роста, таких как EGFRs, инсулиноподобный фактор роста 1R (IGF1R), c-Src, Shc, и регуляторная p85α субъединица PI3K. Это взаимодействие между рецептором эстрогена и рецепторами фактора роста является двусторонним: например, экспрессия конститутивного гена HER2 может усилить передачу сигнала, опосредованную ER, что приводит к нечувствительности к терапии антиэстрогенами. Так, предполагается, что активация HER2/IGF1R/EGFR играет роль в приобретенной и возникшей de novo устойчивости к терапии антиэстрогенами.
Сигнальный путь эстрогенового рецептора является важной мишенью в лечении рака молочной железы. За последние десятилетия было разработано множество агентов, как связывающихся непосредственно с рецептором (селективные модуляторы ER: тамоксифен, ралоксифен, фульвестрант), так и снижающие продукцию эндогенного эстрогена (ингибиторы ароматазы, абляция яичников). Последние исследования показывают, что длительная терапия тамоксифеном (10 лет) предпочтительнее 5-летней, а 5-летнее лечение ингибитором ароматазы является стандартным после проведенной терапии тамоксифеном вне зависимости от продолжительности у женщин в постменопаузе. Несмотря на то, что эти высокоэффективные препараты существенно изменили показатели смертности, врожденная или приобретенная резистентность к ним встречается достаточно часто. Согласно последним данным, назначение ингибиторов путей ростовых факторов в совокупности с антиэстрогенной терапией может помочь преодолеть резистентность. Так, ингибитор протеинкиназы mTOR темсиролимус применяется вместе со стероидным ингибитором ароматазы экземестаном в качестве нового стандарта терапии при прогрессии заболевания на фоне лечения нестероидным ингибитором ароматазы при наличии метастазов. Проблемой для онкологов является выявление оптимальных биомаркеров, позволяющих определить пациентов, у которых применение тамоксифена или ингибитора ароматазы в совокупности с ингибитором mTOR будет максимально эффективно. Так, тесты Oncotype DX, IHC4 и BCI позволяют предсказать поведение ER-позитивной опухоли и определиться со стратегией лечения.
Сигнальные пути рецепторов факторов ростаx
Сигнальные пути рецепторов факторов роста – в частности, тирозинкиназных рецепторов – играют важную роль в обеспечении пролиферации и клеточного выживания и строго регулируются. При изучении рака молочной железы особое внимание уделяется семейству белков ErbB, однако в поисках новых терапевтических мишеней активно исследуются многие другие пути факторов роста, прежде всего рецепторы IGF. Избыточная активация их сигнальных путей осуществляется благодаря нескольким механизмам, включая избыточную экспрессию лиганда, мутации по типу «приобретения функции», наличие или отсутствие амплификации гена, генетические перестройки и формирующиеся гибридные белки с онкогенным потенциалом. Все эти факторы могут приводить к нарушению киназной активности и активации вторичных посредников, что ведет к стимуляции клеточного роста.
Рецептор эпидермального фактора роста 2
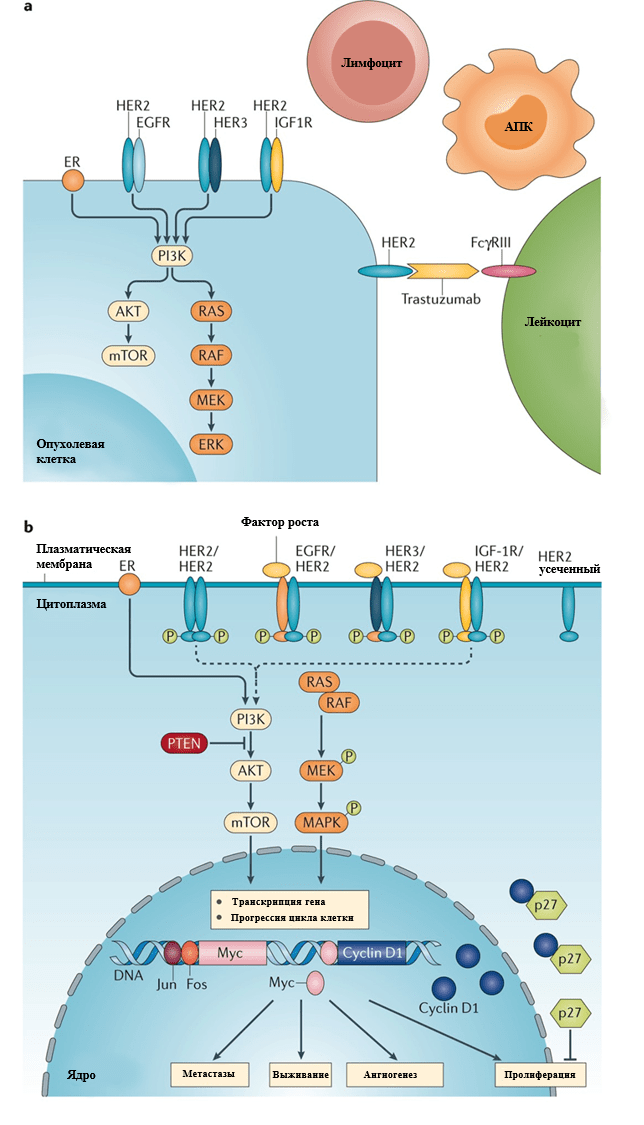
HER2 (EGFR2 или ErbB2) является членом семейства рецепторных тирозинкиназ, которое также включает EGFR (HER1, ErbB1), ErbB3, и ErbB4. Связывание лиганда с внеклеточным доменом рецептора ErbB1, ErbB3 и ErbB4 запускает гомо- и гетеродимеризацию и активацию киназ. Белок HER2 существует в закрытой конформации и не имеет лиганда, однако является предпочтительным партнером димеризации для HER1, HER3 и HER4. На молекулярном уровне, амплификация HER2 ассоциирована с нарушением регуляции фазы G1/S клеточного цикла путем повышения активности циклинов D1, E и cdk6, а также деградации p27. HER2 также взаимодействует с важными вторичными посредниками, включая содержащие домен SH2 протеины (такие как Src киназы).
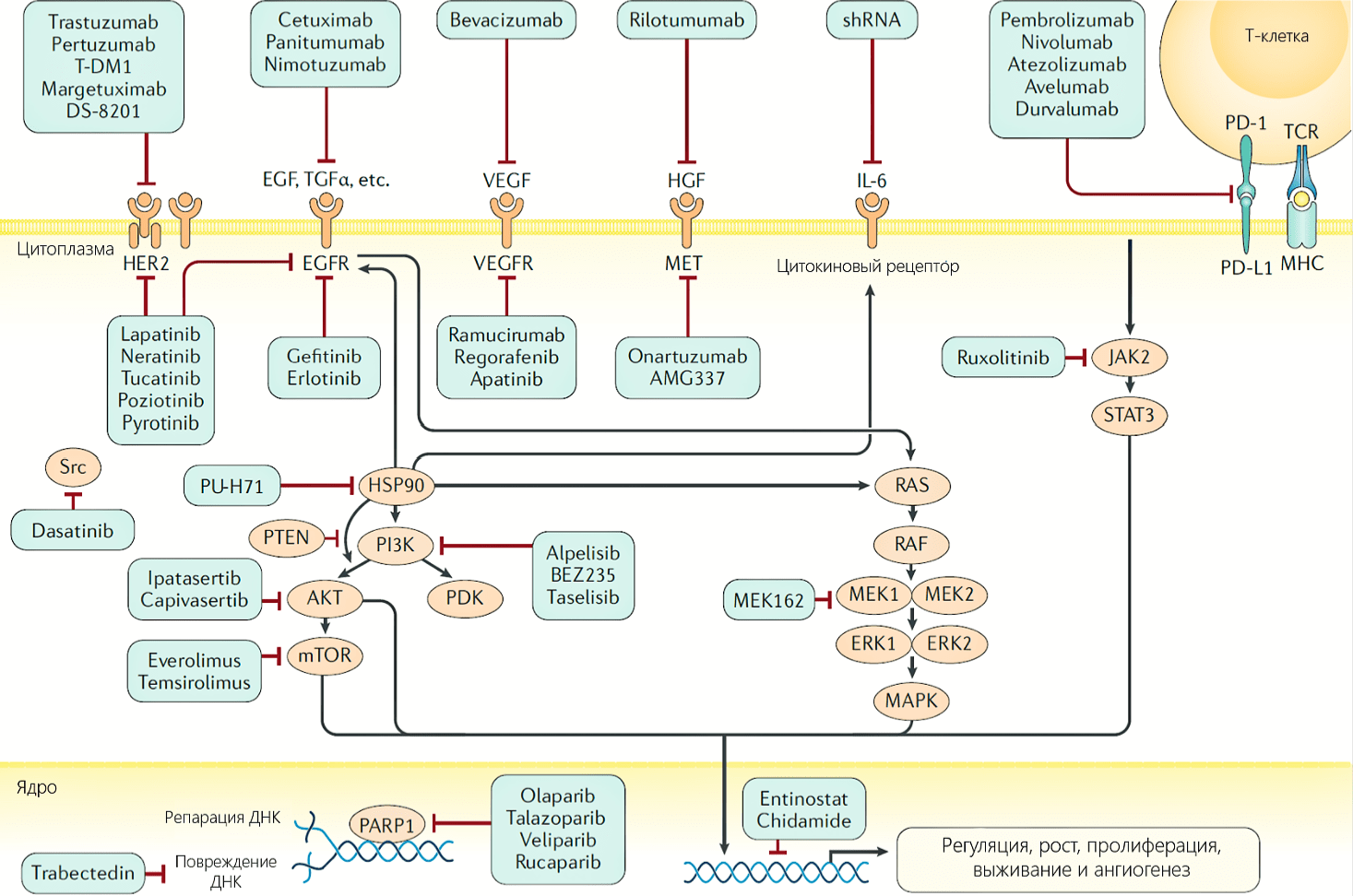
Отмечается, что амплификация HER2 или избыточная экспрессия белка (обнаруживается в 20% инвазивных случаев рака молочной железы) ассоциирована с ускоренным клеточным ростом и пролиферацией, плохим клиническим прогнозом и эффективностью применения анти-HER2 моноклонального антитела – трастузумаба. Множественные рандомизированные клинические испытания показали, что добавление трастузумаба к химиотерапии улучшает выживаемость у пациентов как на ранних стадиях заболевания, так и при наличии метастазов, что привело к его включению в стандартный протокол лечения пациентов с HER2-положительным раком молочной железы. Кроме того, некоторые другие HER2-направленные агенты были одобрены для лечения метастатических форм. Один из них, препарат пертузумаб, препятствующий гетеродимеризации HER2 с HER3, был одобрен в качестве неоадъювантной терапии у пациентов с ранними стадиями рака молочной железы, а также в комбинации с трастузумабом при наличии метастазов. К другим малым молекулам, воздействующим на путь HER2, относится лапатиниб и трастузумаб эмтанзин (TDM-1). Они применяются для лечения пациентов с метастазами, которые ранее получали терапию трастузумабом. Также недавно был одобрен нератиниб для применения у пациентов с ранней стадией заболевания, до этого лечившихся трастузумабом. Эти достижения в области таргетной терапии HER2-позитивного заболевания иллюстрирует важное значение воздействия на ключевой молекулярный драйвер в клинической практике.
Так, механизм действия препаратов, направленных на HER2, заключается в том, что они, воздействуя на различные участки тирозинкиназы, ингибирует нижележащие сигнальные каскады, что приводит к торможению пролиферации и стимулированию апоптоза. Трастузумаб дополнительно запускает иммунный ответ, что обуславливает гибель клетки механизмом антитело-зависимой клеточной цитотоксичности. Трастузумаб, пертузумаб и лапатиниб тормозят передачу сигнала через каноничные сигнальные пути, однако могут отличаться в степени ингибирования сигнальных путей MAPK и PI3K-AKT. Это происходит вследствие различной степени торможения корецепторов HER1, HER3, и HER4, что имеет разное значение для каждого из путей. Так, например, лапатиниб ингибирует HER2 и EGFR (HER1), оказывая большее воздействие на Ras-MAPK путь. Пертузумаб тормозит HER3 гетеродимер и в основном влияет на PI3K-AKT путь. Нератиниб, пероральный ингибитор тирозинкиназы, необратимо ингибирует EGFR, HER2 и HER4, а также снижает аутофосфорилирование EGFR и HER2, что приводит к снижению сигналинга MAPK и PI3K-AKT. Трастузумаб эмтанзин, или TDM-1, конъюгат моноклонального антитела и лекарственного средства, обеспечивает таргетную доставку ингибитора полимеризации тубулина DM1 в клетках с гиперэкспрессией HER2. И нератиниб, и трастузумаб эмтанзин были разработаны для пациентов с резистентностью к трастузумабу. Нератиниб тормозит фосфорилирование в нижележащих участках сигнального пути, а TDM-1 обеспечивает доставку цитотоксического средства в HER2-положительные опухоли независимо от HER2-сигналинга. Тем не менее, несмотря на указанные достижения, у пациентов с HER2-положительным раком молочной железы отмечается агрессивное течение заболевания, и дальнейшие исследования помогут улучшить прогноз у этой группы больных.
RAS и фосфатидилинозитол-3-киназный сигнальные пути
Дублирование и перекрест нескольких разных сигнальных путей является частым механизмом стабилизации системы вторичных посредников. В то же время, некоторые нижележащие посредники изучаются особенно внимательно вследствие их функциональной важности и терапевтической значимости. В публикациях «Атласа ракового генома» отмечается, что преимущественное значение при раке молочной железы имеют пути PI3K/AKT и Ras-MAPK из-за распространенности в них мутаций, амплификаций, а также частой избыточной активации этих путей.
Сигнальный путь PI3K/AKT является центральным сигнальным путем многих тирозинкиназных рецепторов, регулируя клеточный рост и пролиферацию. Активирующие мутации в гене, кодирующем каталитическую субъединицу p110α фосфатидилинозитол-3-киназы (PIK3CA), могут являться значимым фактором в прогрессии рака молочной железы. Место мутации различно в зависимости от молекулярного подтипа опухоли. Так, активирующие мутации в семействе генов AKT встречаются в 2-4% случаев рака молочной железы, исключая базальноподобный подтип, где они отмечаются редко. Мутации или сниженная экспрессия (в основном, вследствие метилирования) гена-супрессора PTEN приводят к нарушению его функции (инактивации каталитической единицы p110 путем дефосфорилирования) и наблюдаются во многих опухолях молочной железы. В результате, активация пути PI3K приводит к фосфатидилинозитол-3-зависимой киназа-опосредованной активации нескольких киназ, включая AKT1, AKT2 и AKT3. На данный путь воздействует ипатасертиб, АТФ-конкурентный ингибитор AKT, который продемонстрировал эффективность в лечении трижды негативного рака молочной железы.
Кроме AKT, существуют нижележащие эффекторы пролиферации PI3K-пути, включая mTOR комплекс 1 (TORC1), который состоит из mTOR, а также дополнительных белков raptor, и mLst8. Данный путь связан с эндокринной резистентностью. TORC1 осуществляет стимуляцию роста путем активации S6-киназы 1 и супрессии белка 4E-BP1, ингибируюшего кэп-зависимую трансляцию. По результатам исследований, mTOR-raptor является ключевой мишенью противоопухолевой терапии — так, препарат эверолимус, который был одобрен для лечения в совокупности в ингибиторами ароматазы.
Сигнальный путь ras/raf/MEK/MAPK также является важным звеном для множества рецепторов фактора роста. На данный момент, применение ингибиторов MEK-пути (например, ингибитора raf сорафениба) имело умеренный успех в качестве монотерапии, однако его комбинация с другими препаратами, согласно исследованиям, может быть также эффективна.
Циклинзависимые киназы
Циклинзависимые киназы (CDKs) являются серин/треонин-киназами, которые участвуют в регуляции клеточного цикла и играют неотъемлемую роль в росте и пролиферации опухолевых клеток. Существует 12 различных циклинзависимых киназ, которые функционируют в различные фазы клеточного цикла. Ключевыми регуляторами G1/S перехода являются CDK2, CDK4, и CDK6, в то время как CDK1 функционирует в ходе митоза. CDK4 и CDK6 работают в раннюю G1 фазу и играют значимую роль в переходе клетки от состояния покоя к активному синтезу ДНК и делению. Эти две киназы активируются путем связывания с циклином D1. Циклин D1 формирует комплекс с CDK4/6, и нарушение регуляции является звеном патогенеза рака молочной железы.
Белок ретинобластомы (Rb), опухолевый супрессор, взаимодействуя с белками p107 и p130, связывает про-пролиферативные белки, факторы транскрипции E2F. Находясь в гипофосфорилированном состоянии, Rb связывается с семейством транскрипционных факторов E2F, что тормозит прогрессию из фазы G1 в фазу S клеточного цикла. Когда циклин и комплекс циклин-зависимых киназ фосфорилируют Rb в pRb, происходит высвобождение E2F, что приводит клетку к вхождению в фазу S. Сигналинг через эндоплазматический ретикулум активирует экспрессию циклина D1, приводит к активации CDKs и фосфорилированию Rb, что стимулирует пролиферацию опухолевых клеток. С другой стороны, циклин D1 способствует транскрипции ER, потенциируя эффект эстрогена. Негативная регуляция циклин/CDK комплекса осуществляется семейством белков INK4 и CIP/KIP, которые взаимодействуют с CDK4/6 и ингибируют активность циклина D1.
Было показано, что ингибиторы CDK4/6, такие как палбоциклиб, рибоциклиб и абемациклиб, улучшают прогноз у пациентов с экспрессирующим гормональные рецепторы местно-распространенным или метастазирующим раком молочной железы. При ER-положительных и HER2-положительных опухолях молочной железы отмечается активность циклин D/CDK пути. Амплификация циклина D, прежде всего, отмечается в люминальных А, люминальных В и HER2-положительных опухолях молочной железы с мутацией или потерей Rb в базальноподобных раках.
Заключение
Понимание молекулярных основ развития и прогрессирования злокачественных опухолей необходимо для разработки и применения таргетной терапии, существенно влияющей на прогноз и течение заболевания. Учитывая ведущую роль рака молочной железы в структуре онкологической заболеваемости женщин, а также высокий уровень смертности, планирование лечения на основе данных генетического анализа конкретного пациента представляется чрезвычайно важным. Так, несмотря на накопленные за последнее время данные, касающиеся онкогенеза, продолжается активный поиск новых мишеней, разработка препаратов к которым позволит существенно увеличить эффективность лечения рака молочной железы.
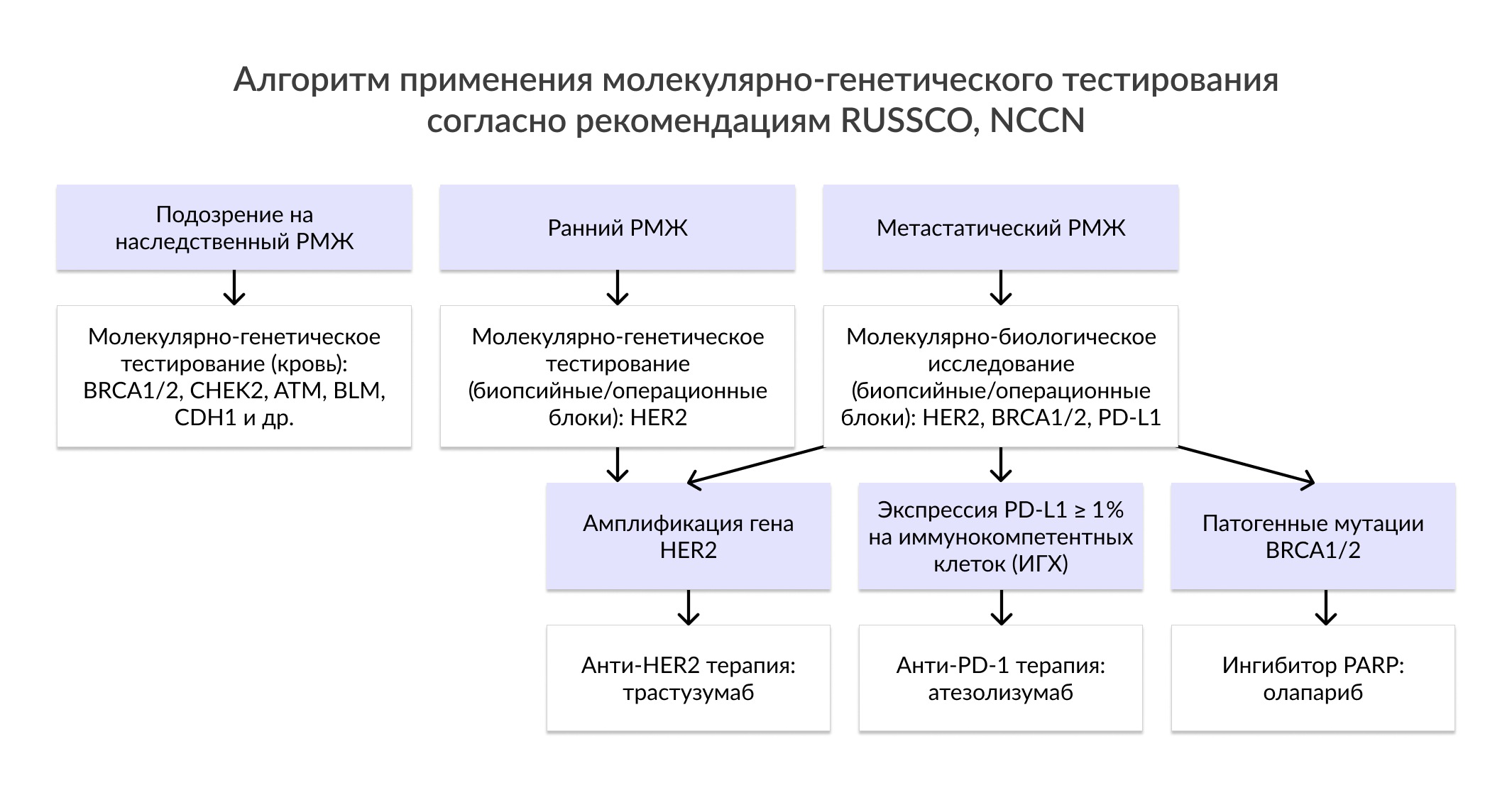
| Молекулярное тестирование | Препараты, одобренные на территории РФ, а также используемые в рамках клинических исследований (*) |
| HER2 | Анти-HER2 антитела: трастузумаб, пертузумаб,трастузумаб-эмтанзин; лапатиниб |
| BRCA1/2 | Ингибитор PARP: олапариб, талазопариб |
| Микросателлитная нестабильность | Анти-PD-1 антитела: пембролизумаб* |
| PIK3CA | Ингибитор PI3K: алпелисиб |
| PD-L1 | Анти-PD-L1 антитела: атезолизумаб |
Зеленый — чувствительность к терапии, Красный — резистентность к терапии.
Ген |
Краткая информация |
| Амплификация гена HER2 | • Распространенность амплификации гена HER2 составляет около 25%. • Определение статуса HER2 рекомендовано всем пациентам с РМЖ для установления молекулярно-биологического подтипа опухоли с целью определения плана проведения (нео-) адъювантной лекарственной терапии. • Наличием амплификации гена HER2 характеризуются два подтипа: люминальный В (HER2 положительный) и HER2 положительный (не люминальный). • Амплификации HER2 служит показанием для применения анти-HER2 терапии, трастузумаба и/или пертузумаба, в комбинации с химиотерапией у пациентов с ранним и метастатическим РМЖ в зависимости от молекулярно-биологического подтипа опухоли. Показания: Рекомендовано всем пациентам с раком молочной железы для определения показаний к применению анти-HER2 терапии. |
| Мутации в генах BRCA1/2 | • Распространенность мутаций в генах BRCA1 и 2 составляет 1:300 и 1:800, соответственно. • Мутации в данных генах приводят к значительному увеличению риска развития РМЖ в 7 раз по сравнению с уровнем риска в общей популяции. • Также мутации в данных генах являются высокопенетрантными, хотя вероятность манифестации рака у носителей варьирует даже в семьях, имеющих одинаковую мутацию. Пенетрантность для РМЖ находится в диапазоне от 41% до 90%. • В России характерен выраженный эффект-предшественника, т.е. преобладание мутации 5382insC в гене BRCA1 (до 90%) у населения, преимущественно славянского происхождения. Также распространенными мутациями являются: 185delAG, 4153delA, 3819delGTAAA, 3875delGTCT, 300T>G (Cys61Gly), 2080delA в гене BRCA1; 6174delT в гене BRCA2. • Помимо высокого риска контралатерального РМЖ и раннего возраста манифестации наследственный синдром ассоциирован с тройным негативным фенотипом. • У BRCA-положительных пациентов c метастатическим РМЖ рекомендовано применение PARP-ингибитора олапариба. Показания: Рекомендовано всем пациентам с раком молочной железы при наличии подозрений на наследственный характер заболевания. Рекомендовано пациентам с метастатическим РМЖ для определения показаний к применению PARP-ингибитора олапариба. |
| Мутации в гене PIK3CA |
• Распространенность составляет 20-40% при раннем РМЖ, причем чаще встречается в опухолях, имеющих положительную экспрессию гормональных рецепторов (HR+). • Пациенты с тройным негативным фенотипом РМЖ (HR-/HER2-) с наличием мутаций в гене PIK3CA имеют более благоприятный прогноз по сравнению с пациентами с аналогичным фенотипом и отрицательным статусом PIK3CA. Показания: Рекомендовано пациентам с распространенным или метастатическим раком молочной железы, имеющий статус HR+ и отрицательный статус HER2, с прогрессированием заболевания во время/после проведения режимов эндокринной терапии для определения показаний к проведению терапии алпелисибом в комбинации с фулвестрантом. |
| Экспрессия мРНК PD-L1 | • Терапия ингибиторами контрольных точек иммунитета оказывается неэффективным во всех случаях низкой экспрессии PD-L1 (<1%). Показания: Рекомендовано пациентам с метастатическим РМЖ для определения показаний к проведению иммунотерапии. |
| Микросателлитная нестабильность (MSI) | • Наличие MSI ассоциировано с ответом на терапию ингибиторами контрольных точек иммунитета. Показания: Рекомендовано пациентам с метастатическим РМЖ для определения показаний к проведению иммунотерапии (NCCN, 2021). |
Список литературы
- DeVita, Vincent T., Jr., Theodore S. Lawrence, and Steven A. Rosenberg. Devita, Hellman, and Rosenberg’s Cancer: Principles & Practice of Oncology. 11th edition. Philadelphia: Wolters Kluwer, 2019.
- Telli ML, Gradishar WJ, Ward JH. NCCN Guidelines Updates: Breast Cancer. J Natl Compr Canc Netw 2019. doi:10.6004/jnccn.2019.5006.
- Daly MB, Pilarski R, Berry MP, Buys SS. Genetic / Familial High-Risk Assessment : Breast, Ovarian, and Pancreatic. NCCN Clin Pract Guidel Oncol 2019.
- Cardoso F, Senkus E, Costa A, Papadopoulos E, Aapro M, André F, et al. 4th ESO-ESMO international consensus guidelines for advanced breast cancer (ABC 4). Ann Oncol 2018. doi:10.1093/annonc/mdy192.
- Harbeck N, Penault-Llorca F, Cortes J, Gnant M, Houssami N, Poortmans P, et al. Breast cancer. Nat Rev Dis Prim 2019. doi:10.1038/s41572-019-0111-2.
- Aftimos P, Azim HA, Sotiriou C. Molecular biology of breast cancer. Mol. Pathol. Mol. Basis Hum. Dis., 2018. doi:10.1016/B978-0-12-802761-5.00026-2.
- Feng Y, Spezia M, Huang S, Yuan C, Zeng Z, Zhang L, et al. Breast cancer development and progression: Risk factors, cancer stem cells, signaling pathways, genomics, and molecular pathogenesis. Genes Dis 2018. doi:10.1016/j.gendis.2018.05.001.