Колоректальный рак
Колоректальный рак (КРР) является одним из наиболее распространенных злокачественных новообразований: как с точки зрения заболеваемости, так и смертности. На основании факторов риска развития КРР выделяют 3 основных типа: спорадический, наследственный и семейный. Спорадический КРР, при котором отсутствует семейный анамнез, составляет приблизительно 70% всех случаев, преимущественно у лиц старше 50 лет. Для данных опухолей ключевыми триггерами развития являются особенности диеты и факторы окружающей среды. Менее 10 процентов пациентов с КРР имеют истинную наследственную предрасположенность к развитию опухоли. Данный тип представлен наследственными синдромами, которые подразделяются в зависимости от того, являются ли полипы толстой кишки основным проявлением заболевания. Заболевания с полипозом включают в себя семейный аденоматозный полипоз (FAP), MUTYH-ассоциированный полипоз и гамартоматозный полипоз (например, синдром Пейтца-Егерса, ювенильный полипоз, PTEN-ассоциированный синдром гамартомных опухолей (синдром Коуден). Те случаи, при которых не наблюдается полипоз, представляет собой синдром Линча (наследственный неполипозный рак толстой кишки). Все вышеперечисленные синдромы связаны с высоким риском развития КРР. Третий, наименее изученный тип, представляет собой “семейный” КРР, на который приходится до 25 процентов случаев. У данной группы пациентов присутствует семейный анамнез, однако данные пациенты не соответствует критериям одного из наследственных синдромов, описанных выше. Данная группа людей имеет повышенный риск развития КРР, однако не такой высокий, как при наследственных синдромах. Наличие единственного родственника первой линии родства с КРР (то есть родитель, ребенок, родной брат) увеличивает риск развития КРР в 1,7 раза по сравнению с общей популяцией. Риск развития КРР еще больше возрастает, если у двух родственников первой линии родства есть КРР или если у единственного родственника диагностировано заболевание до 55 лет.
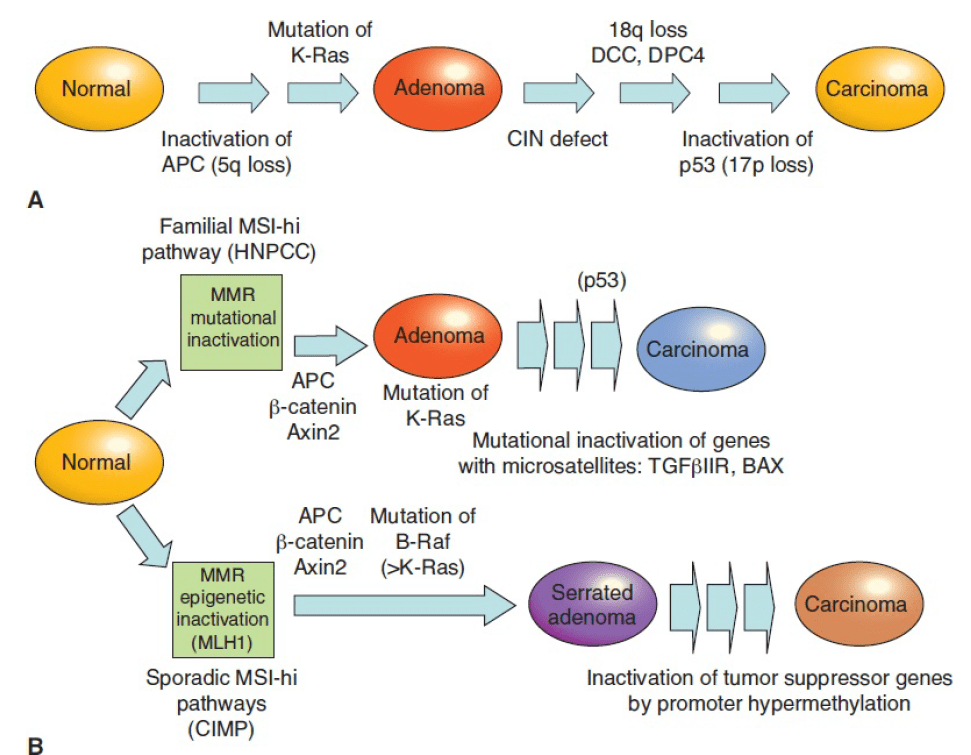
Почти все случаи КРР развиваются из доброкачественных полипов-предшественников, когда «сторожевые» мутации инициируют избыточный рост эпителия путем конститутивной активации сигнального пути Wnt, а комбинация добавочных мутаций способствуют инвазии и метастазированию (см. Рис. 1). Полипы на ножке размером более 1 см представляют наибольший риск с 15% вероятностью прогрессии в инвазивный рак в течение 10 лет. Распространенность полипов среди населения США достигает 50% к возрасту 70 лет, не смотря на это, риск развития КРР составляет только 5% на протяжении всей жизни, что связывают с тем, что лишь немногие полипы становятся инвазивными, а аберрации, связанные с их озлокачествлением, имеют свойство накапливаться с течением времени. Тем не менее, эндоскопическая резекция аденом кишки снижает вероятность возникновения колоректального рака и связанную с ним смертность.
На сегодняшний день нет единого консенсуса о молекулярной классификации КРР. Кроме этого, ее клиническое применение до сих пор вызывает множество вопросов. Однако, с точки зрения понимания механизмов развития КРР и разработки новых таргетных лекарственных средств данная классификация очень перспективна.
Около 80% случаев КРР связаны с хромосомной нестабильностью (CIN) – их дупликация, потеря, транслокации хромосом и их участков ведут к различным амплификациям, делециями и перестройкам генов. Опухоли, имеющие CIN, могут быть наследственными или спорадическими. Нарушения расхождения хромосом, обусловленные такими факторами сегрегации как BUB1, могут лежать в основе хромосомной нестабильности, но непосредственно в этот процесс вовлекаются лишь немногие гены. В среднем при каждом случае КРР происходит делеции 17 генов, а также амплификация более 12 генов, совместно с делециями вызывая потерю гетерозиготности (LOH). В большинстве случаев происходит амплификация или гиперэкспрессия онкогенов ERBB2, MYC, KRAS, MYB, IGF2, CCND1 и CDK8, захватывая, как правило, участки соседних генов. Однако около половины изменений числа копий этих генов встречается и при других видах новообразований. Таким образом, при КРР наблюдается нарушения патогенетических путей репликации и тканевого гомеостаза клеток, многие из которых присущи различным видам рака, а некоторые встречаются только при КРР. У специфических цитогенетических аномалий обычно не наблюдается корреляций с клиническими исходами и особенностями заболевания. Последние данные свидетельствуют о том, что помимо участия в формировании различных генетических альтераций, хромосомная нестабильность вызывает переход ДНК в цитозоль, таким образом активируя сигнальный путь неканоничного ядерного фактора каппа В (NF-κB), способствующий метастазированию.
Около 20% случаев КРР является эуплоидным, но имеют дефекты репарации ДНК (MMR), которые в результате приводят к микросателлитной нестабильности (MSI). MMR могут развиваться спорадически, быть ассоциированными с метилированием CpG-островков (CIMP) или являться результатом генетической предрасположенности при наследственном неполипозном колоректальном раке (синдром Линча). Мутации накапливаются в онкогенах KRAS или BRAF, в опухолевом супрессоре p53 и в микросателлит-содержащих генах, уязвимых к дефектам MMR, таким как TGFβIIR. Эпигенетическая инактивация MMR гена MLH1 и появление точечных мутаций гена BRAF особенно часто встречаются в зубчатых аденомах, которые прогрессируют путем ингибирования генов-супрессоров опухоли с помощью гиперметилирования промотора. Развитие КРР из аденомы может занять от нескольких лет до десятилетий, процесс ускоряется в присутствии дефектов MMR.
Несмотря на то, что 20% случаев КРР являются эуплоидными, они несут тысячи небольших инсерций и делеций или точечных мутаций вблизи рядов нуклеотидных повторов, в совокупности обозначающихся как MSI, как результат дефектной репарации ДНК (MMR). До трети подобных случаев связаны с семейным синдромом Линча. Опухоли с микросателлитной нестабильностью (MSI) обычно возникают в восходящей ободочной кишке, ассоциированы с мутацией BRAF V600E, устойчивы к адъювантному лечению 5-фторурацилом и лучше отвечают на иммунотерапию блокады белка запрограммированной смерти клеток 1 (PD-1), чем другие виды рака. Анеуплоидия как форма хромосомной нестабильности связана с худшим прогнозом, чем MSI-положительные опухоли. Некоторые авторы отдельно рассматривают CIMP-положительный зубчатый КРР, но вследствие того, что его молекулярные, клинические и патоморфологические особенности во многом соответствуют MSI опухолям, The Cancer Genome Atlas (TCGA) и другие группы исследователей объединяют эти два типа в одну категорию – «гипермутационный» КРР.
Среди приблизительно 3% спорадических случаев КРР, являющихся гипермутационными, но не имеющих MSI, большинство несут соматические мутации в экзонуклеазном домене POLE. Кроме того, некоторые виды КРР с доминантным наследованием несут специфические дефекты в клетках зародышевой линии в POLE или POLD1, экзонуклеазных генах, кодирующих корректирующую ДНК-полимеразу ε и δ с ведущей и отстающей цепи. Несмотря на то, что опухоли несут тысячи мутаций, микросателлитные участки остаются стабильными.
Молекулярные закономерности развития КРР
Конститутивная активация Wnt-пути, запускаемая «сторожевыми» мутациями в генах APC, CTNNB1, RNF43 или RSPO, приводит к формированию аденомы. Случаи КРР значительно варьируют по мутационному профилю, а также по времени возникновения мутаций. Ранние исследования оценивали, что в среднем в 1 случае КРР наблюдается 81 мутация, которые чаще всего обнаруживаются в генах APC, KRAS, TP53, PIK3CA, реже в таких генах с известной функцией, как BRAF, но в большинстве случае мутации были специфичны и встречались только в единичных случаях. Геномные исследования сотен случаев КРР и неизмененной слизистой толстой кишки подтверждают эти результаты и позволяют каталогизировать генетические паттерны КРР (см. Рис. 2). Некоторые новые мутации, обнаруженные в последних исследованиях, находятся в генах, кодирующих возможные мишени для лекарственной терапии, такие как киназы, которые могут оказывать плейотропный эффект на выживаемость, рост опухоли и её метастазирование. В совокупности гены, модифицирующие эпигеном, представляют собой большой класс наиболее часто мутирующих генов. В MSI-положительных опухолях, в частности, обнаруживаются мутации в гене ARID1A, кодирующим фактор ремоделирования хроматина. Случаи КРР, возникающие у афроамериканцев, часто имеют характерный профиль, включающий мутации в генах EPHA6 и FLCN. Кроме того, около 10% данных случаев КРР имеет моноаллельные миссенс-мутации в гене SOX9, транскрипторном факторе, который высоко экспрессируется в стромальных и стволовых клетках крипт кишечника.
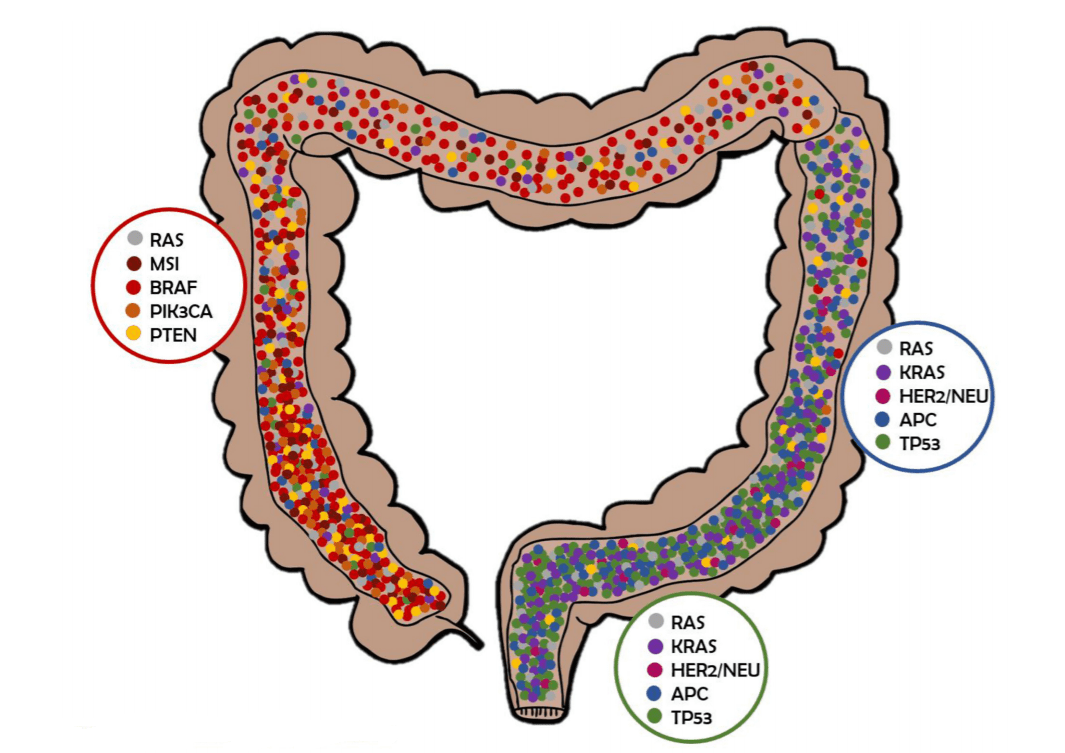
Колоректальный рак прогрессирует, активируя или ингибируя пути, включающие продукты множества генов. Некоторые гены, задействованные в жизненно важных процессах клетки, более подвержены мутациям, чем другие, а одной мутации в критическом гене может быть достаточно для того, чтобы нарушить определенный сигнальный путь без необходимости в дополнительных мутациях. Таким образом, мутации в генах KRAS и BRAF, которые можно обнаружить в половине всех случаев КРР и являющиеся взаимоисключающими, связаны с активацией альтернативных путей внутриклеточного сигнального пути рецептора эпидермального фактора роста (EGFR). Хотя эти примеры говорят в пользу парадигмы, согласно которой частое возникновение генетических аберраций даёт селективное преимущество опухолевым клеткам, одного наличие других мутаций не обязательно означает их патогенетическую роль. Мутации-«пассажиры», вне зависимости от их ассоциации с CIN или MSI, не дают никаких преимуществ и даже могут нанести ущерб клеткам опухоли. Поэтому для наделения мутации статусом «драйверной» необходимы 2 особенности: рекуррентное событие, определяемое в крупных когортах, и вклад в озлокачествление, продемонстрированный в экспериментах, проведение которых может быть очень трудоемким. Редкие события, ведущие к неоплазии, имеют тенденцию концентрироваться в генах, контролирующих клеточную адгезию, сигналинг, топологию ДНК и клеточный цикл. Наиболее распространенные мутации при спорадическом КРР редко коррелируют со специфической клинической или гистологической картиной, однако некоторые генотипы способны определять подтип заболевания и чувствительность опухоли к определенной терапии. Например, мутации в генах KRAS и BRAF препятствуют клиническому ответу на антитела к EGFR, а КРР с наличием MSI отличается высокой чувствительностью к ингибиторам контрольных точек иммунитета.
Основные способы эпигенетического контроля в клетках млекопитающих включают метилирование CpG-динуклеотидов и ковалентную модификацию остатков некоторых гистонов. По сравнению с нормальным эпителием кишки КРР и даже доброкачественные аденомы имеют на 8-15% меньше общего уровня метилирования ДНК. Гипометилирование ДНК может снижать точность расхождения хромосом путем уменьшения перицентромерного метилирования и нарушения импринтинга в таких локусах, как IGF2. Однако его патогенетическая роль, если таковая имеется, остается неясной. В исследованиях на мышиных моделях было продемонстрировано, что глобальное гипометилирование снижает восприимчивость к опухолям, в то время как отсутствие метилтрансферазы DNMT3B замедляет, а гиперэкспрессия DNMT3B ускоряет опухолевую прогрессию. На фоне наличия в опухоли полногеномного гипометилирования ДНК определенные виды КРР с CIMP демонстрируют координированное гиперметилирование множества промоторов CpG-островков, ассоциированных с ослаблением транскрипции генов-супрессоров опухоли, таких как HIC1 и Wnt. Анализ полногеномного метилирования ДНК таких форм КРР выявляет характеристики, отличающие их от CIN-положительного КРР с мутациями в гене KRAS: происхождение из зубчатой аденомы, стойкая ассоциация с мутациями в гене BRAF, правостороннюю локализацию, наличие MSI, опухоли с метилированием гена MLH1, различные профили экспрессии РНК.
Описание онкогенов, приводящих к развитию КРР
Исследование наиболее часто возникающих мутаций делает неоценимый вклад в понимание сигнальных путей опухолей и разработку их рациональной терапии (см. Рис. 3). Высокая суммарная частота мутаций в генах KRAS, BRAF и PIK3CA ставят EGFR и его нижележащие эффекторы внеклеточных сигнал-регулирующих киназ (ERK, также известные как митоген-активируемые протеинкиназы (MAPK)) во главу различных исследований и терапевтических разработок.
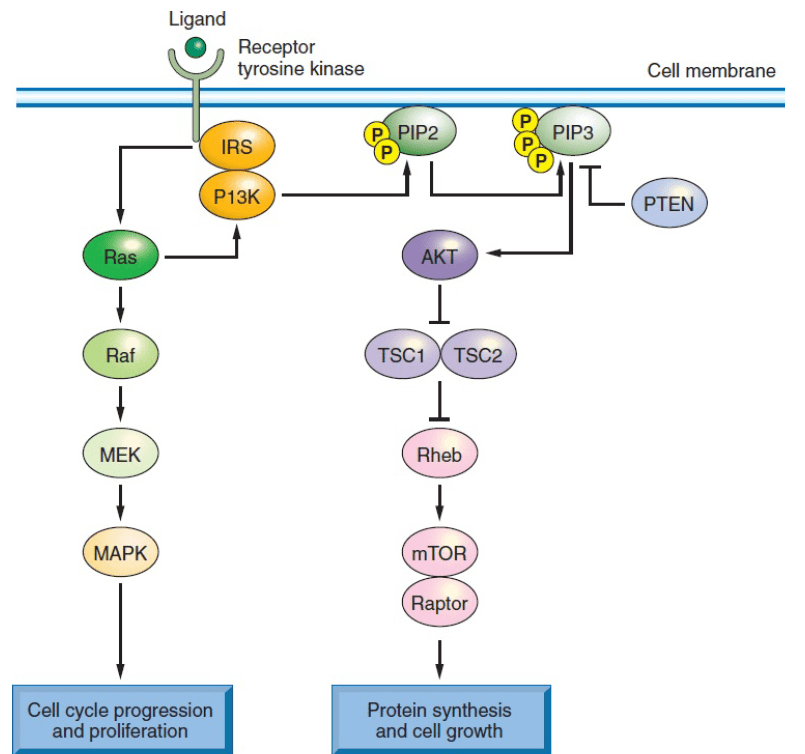
На рисунке 3 представлены наиболее распространенные генетические альтерации при КРР в составе сигнального пути тирозинкиназы, где одна из главных ролей отведена эндотелиальному фактору роста. Онкоген KRAS, мутации в котором встречаются в 40% случаев КРР, активирует рецептор с помощью белков RAF (включая BRAF, мутация в котором встречается от 5% до 8% КРР) фосфатидилинозитол 3-киназы (PI3K), при которой мутация в каталитической субъединице PIK3CA встречается в 15-20% случаев КРР. Эти трансдукторы, в свою очередь, активируют внутриклеточную митоген-активируемую киназу (MAPK) и AKT или пути мишени рапамицина млекопитающих (mTOR), соответственно. Наиболее распространенные мутации вызывают неконтролируемую активацию, не зависящую от действия фактора роста, вызывая нарушение регуляции пролиферации, синтеза белков и метаболизма клетки. Они также представляют собой многообещающую мишень для терапевтического воздействия на аберрантно активированные сигнальные пути.
Онкогены KRAS, BRAF и PIK3CA
Ras, семейство небольших G-протеинов, отвечает за передачу сигналов факторов роста и аберрантно активируется при различных злокачественных новообразованиях. Мутации в гене KRAS обнаруживаются в 40% всех случаев колоректального рака, а в гене NRAS <5% случаев. Мутации обоих генов локализуются в 12 или 13 кодонах, реже в 61 кодоне. Мутации KRAS возникают даже в образованиях с низким потенциалом злокачественности, в таких как очаги аберрантных псевдоаденоматозных крипт или маленькие полипы. Частота возникновения этих мутаций увеличивается с ростом размера поражения. Изолированные мутации в гене KRAS не вызывают образования аденом у мышей, в то время как их комбинация с мутацией в гене AРС ускоряет опухолевую прогрессию; их ингибирование в клетках КРР или ксенотрансплантатах препятствует клеточному росту. Среди множества сигналов факторов роста, которые KRAS передает в различных тканях, его активность в эпителии толстой кишки и клетках КРР наиболее связана с EGFR. Мутантный KRAS блокирует EGFR-сигналинг в активированном состоянии. Следовательно, антитела к EGFR неэффективны в этих подтипах КРР.
Так как KRAS является плазматическим мембран-ассоциированным трансдуктором сигнала для рецептора тирозинкиназы, его мутантная форма может потенциально приводить к нарушению регулирования некоторых эффекторных путей клеточного выживания, пролиферации и инвазии. Мутация KRAS индуцирует конститутивное фосфорилировани ERK, который, в свою очередь, фосфорилирует протеины, которые контролируют переход клеточного цикла от G1 к S. Хотя другие, KRAS-опосредованные, пути факторов роста также активируются каскадом MEK/ERK, сигналинг при КРР чаще всего регулируется именно активацией мутаций в генах KRAS или BRAF. Мутации в последнем гене встречаются приблизительно в 10% случаев КРР, особенно если он ассоциирован с MSI и CIMP. Мутация V600E, наиболее распространённая мутация в гене BRAF при КРР, меланоме и других видах рака, воздействует на аминокислотный остаток в петле активации киназного домена и активирует функцию киназы. Активация BRAF также приводит к фосфорилированию ERK, высвобождая внутренние ограничители клеточного роста. Действительно, мутации в генах KRAS и BRAF являются взаимоисключающими при КРР, представляя собой альтернативные пути, ведущие к одному и то же сигнальному исходу.
В отличие от мутаций KRAS мутация V600E в гене BRAF ассоциирована с негативным прогнозом. Так экспрессия белка BRAFV600E быстро индуцирует персистирующую генерализованную гиперплазию с высокой степенью инвазии крипт, зубчатой морфологией и инвазивным ростом с дисрегуляцией путей Wnt и ERK. Мутация в гене BRAF является маркером ненаследственного КРР у пациентов с MSI. Примечательно, что в то время как BRAFV600E-мутантная меланома отвечает на лечение селективными АТФ-конкурентными ингибиторами BRAF, такими как Вемурафениб, и только спустя месяцы развивает вторичную резистентность, КРР с аналогичной мутацией обладает низким ответом. Это связано с тем, что ингибирование BRAF быстро индуцирует обратный сигналинг EGFR с помощью KRAS и BRAF, что приводит к пролиферации опухоли. Клеткам меланомы удается избегать такой обратной активации, потому что они почти не экспрессируют EGFR.
В дополнение к ERK KRAS также передает сигнал с помощью PI3K, который фосфорилирует внутриклеточный липид PI-4,5-бисфосфонат в 3 позициях, запуская каскад, который способствует выживанию и росту клеток. До 20% КРР несут активирующие мутации в гене PIK3CA, кодирующим каталитическую субъединицу p110 PI3K. Намного реже КРР несет мутации, связанные с геном PIK3R1. Мутации в гене PIK3CA локализуются в экзонах 9 и 20 и, как правило, возникают поздно в переходе аденома-карцинома, вероятно в связи с инвазией. Клеточная активность PI3K находится в антагонизме с продуктом гена PTEN, который активируется – обычно вследствие делеции – в 10% случаев и является распространенной причиной синдрома Коудена. Несмотря на то, что и PI3K, и BRAF в сигнальном пути расположены ниже KRAS, только мутации в генах BRAF и KRAS являются взаимоисключающими, и до одной пятой случаев КРР с мутантным KRAS также несут мутацию в гене PIK3CA, подразумевая, что эти онкогены не являются полностью избыточными. Одной из причин может быть то, что мутантный KRAS неэффективно активирует PI3K-сигналинг. Вероятно, что пути сигналинга онкогенов действуют менее линейно, чем принято полагать. Действительно, параллельные пути сигналинга KRAS с помощью RAF/MEK и PI3K взаимодействуют друг с другом, и оба потока поступают к mTOR, который регулирует клеточный рост, опосредованные питательными веществами. Наконец, инсулиноподобный фактор роста 2 (IGF2) гиперэкспрессирован в 15% случаев КРР в результате амплификации гена, потери импритинга и других механизмов. Гиперэкспрессия IGF2 является взаимоисключающей с генетическими событиями усиления сигналинга PI3K, такими как мутации PIK3CA и делеции PTEN. Это подтверждает предположение, что в нормальных клетках кишки PI3K передает сигналы роста и от EGFR, и от IGF2.
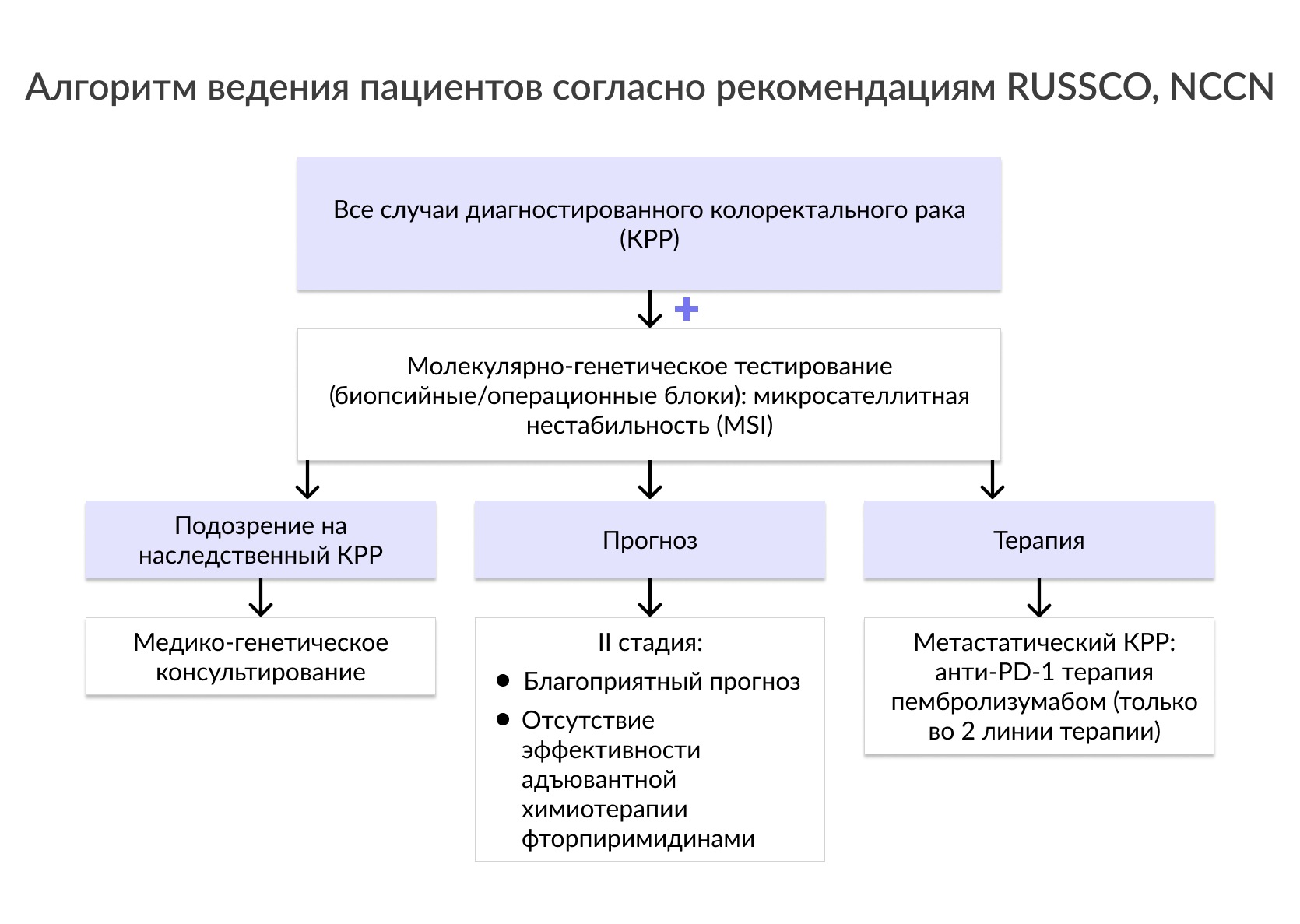
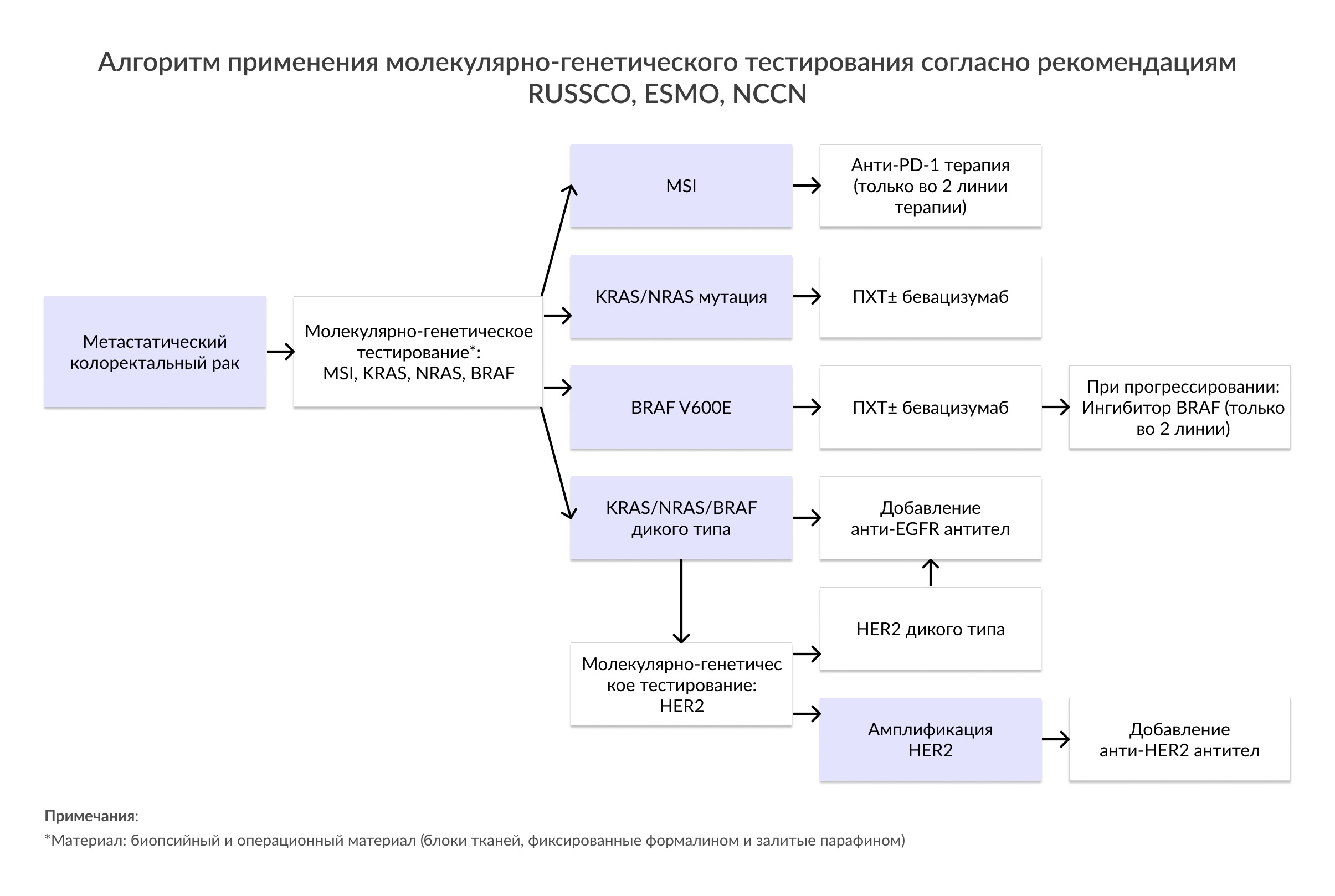
В соответствии с ESMO и NCCN всем пациентам с 4 стадией заболевания рекомендовано определение аберраций во 2, 3, 4 экзонах генов KRAS, NRAS для определения дальнейшей тактики ведения пациента. Наличие мутации в гене KRAS, NRAS ассоциировано с резистентностью к терапии анти-EGFR антителами, такими как цетуксимаб и панитумумаб, у пациентов с метастатическим КРР (RUSSCO, 2019; NCCN, 2020). При наличии у KRAS/NRAS-положительных пациентов потенциально резектабельных метастатических очагов рекомендовано применение стандартных режимов химиотерапии в сочетании с бевацизумабом (RUSSCO, 2019, ESMO, 2018).
Наличие мутации в гене BRAF является причиной резистентности к терапии анти-EGFR антителами, такими как цетуксимаб и панитумумаб, у пациентов с метастатическим КРР (RUSSCO, 2019; NCCN, 2020). Мутация BRAF V600E у пациентов с метастатическим КРР является показанием к назначению BRAF-ингибитора (NCCN, 2020). При наличии у BRAF-положительных пациентов потенциально резектабельных метастатических очагов рекомендовано использование тройного режима химиотерапии в сочетании с бевацизумабом (ESMO, 2018, RUSSCO, 2019). BRAF V600E является негативным прогностическим маркером у пациентов с метастатическим КРР вне зависимости от терапии (ESMO, 2018). BRAF-положительные пациенты имеют значительно ниже показатели общей выживаемости в сравнении с пациентами с наличием мутаций в гене KRAS или диким типом гена BRAF и KRAS (NCCN, 2020). BRAF-положительные опухоли имеют характерный паттерн метастазирования: достоверно чаще отмечается перитонеальный карциноматоз, а также метастазирование в отдаленные лимфатические узлы (ESMO, 2018; Tran B. et al, 2011). Также была показана ассоциация мутации в гене BRAF и наличием неблагоприятных клинико-морфологических характеристик опухоли (NCCN, 2020).
Микросателлитная нестабильность
Микросателлиты – это короткие повторяющиеся участки ДНК распределенные по всему геному. Благодаря своей структуре микросателлиты очень часто подвержены мутациям, которые в норме исправляются системой исправления ошибок репликации.
Система исправления ошибок репликации (mismatch repair system MMR) – это система, состоящая из 4 белков (MLH1, MSH2, MSH6 и PMS2), работа которой направлена на поиск несоответствий в молекуле ДНК и их устранения. Они восстанавливают правильную структуру молекулы и дают ей возможность в дальнейшем продолжать участвовать в матричных процессах. Клетки с нарушением способности к репарации ДНК из-за “выключения” генов MMR накапливают ошибки по всему геному. Биологический «след» дефектной системы — это накопление аномалий в коротких последовательностях нуклеотидных оснований, которые повторяются в геноме от десятков до сотен раз. В частности, несколько генов- регуляторов роста, например, TGFRB2, BAX, рецептор инсулиноподобного фактора роста 2 [IGF2R], содержат микросателлиты в области промотора и поэтому подвержены мутациям сдвига рамки считывания. Это делает клетку уязвимой для мутаций в этих генах, контролирующих рост клеток, и это явление называется микросателлитной нестабильностью (MSI). Таким образом, опухоли, несущие дефектную систему MMR, имеют фенотип MSI. Злокачественные новообразования, у которых отсутствует данные альтерации, имеют фенотип микросателлитной стабильности (MSS).
Помимо того, что MSI является биологическим признаком синдрома Линча, мутантный фенотип также обнаруживается примерно в 15 процентах спорадических случаев КРР. Однако в большинстве этих случаев “выключение” генов происходит не из-за специфической мутации, а из-за эпигенетического явления- гиперметилирования промотора гена системы MMR (обычно MLH1), что приводит к подавлению транскрипции гена.
Спорадические случаи КРР с MSI имеют характерные клинико-морфологические особенности. Такие опухоли часто локализованы в проксимальных отделах толстой кишки, имеют муциновый компонент, содержат лимфоцитарную инфильтрацию, а также часто являются низкодифференцироваными. Примечательно то, что тенденция к наличию лимфоцитарного инфильтрата, вероятно, отражает иммунную активацию Т-клеток, направленных против опухолеспецифических неоэпитопов, возникших в результате мутаций сдвига рамки считывания при микросателлитной нестабильности.
Несмотря на то, что опухоли при синдроме Линча чаще всего являются низкодифференцированными, КРР c MSI ассоциированы с более длительной выживаемостью как при синдроме Линча, так и в спорадических случаях по неясным причинам. Опухоли с MSI имеют сниженную способность к метастазированию (NCCN, 2020). У пациентов со II стадией наличие MSI ассоциировано с благоприятным прогнозом и с отсутствием доказанной эффективности применения адъювантной химиотерапии фторпиримидинами (NCCN, 2020). Следует отметить, что низкодифференцированная опухоль не является достоверным показателем высокого риска рецидивирования у пациентов со II стадией заболевания и MSI (NCCN, 2020). Однако, у пациентов с III стадией КРР данный фенотип не был значимо связан с благоприятным исходом (Klingbiel D et al., 2015; Sinicrope FA et al., 2013). Наличие MSI является показанием для назначения иммунотерапии у пациентов с метастатическим КРР.
Молекулярная классификация КРР
В современную молекулярную классификацию КРР 2015 года включают следующие подтипы:
- CMS1 (иммунный)- встречается в 14% случаев
- CMS2 (канонический) — наиболее частый тип- 37%
- CMS3 (метаболический) – встречается в 13%
- CMS4 (мезенхимальный)- 23% случаев КРР
- Смешанный фенотип — 13%
CMS1
Опухоли, относящиеся к первому подтипу KPP, развиваются из зубчатых полипов. Для них характерно: расположение в проксимальной части толстой кишки; высокая частота встречаемости мутаций BRAF V600E; нарушение системы исправления ошибок репликации (MMR), что в свою очередь приводит к микросателлитной нестабильности; богатая инфильтрация микроокружения опухоли лимфоцитами; гиперметилирование островков CpG.
На ранней стадии заболевания пациенты с MSI (большинство опухолей первого подтипа CMS) имеют лучший прогноз по сравнению с пациентами с MSS. При лечении данного заболевания на второй стадии у таких пациентов наблюдается низкая частота рецидивов. Опухоли CMS1 имеют благоприятный исход при обнаружении их до появления метастазов. В частности, хороший прогноз может быть связан с наличием специфических популяций Т-клеток: CD8 + цитотоксических Т-лимфоцитов, CD4 + Т-хелперов 1 типа и NK-клеток. Тем не менее, после рецидивирования данные опухоли имеют более худший прогноз выживаемости.
CMS2
Данный подтип KPP развивается из аденоматозного полипа и канцерогенез идет по пути хромосомной нестабильности (т. е. CMS2 характеризуется начальной потерей гена-супрессора опухоли APC, за которым следует активирующая мутация в гене KRAS и потеря TP53). Относительно CMS1 данный подтип характеризуется более низким количеством мутаций и является негипермутационным. В опухолях CMS2 происходит активация таких сигнальных путей как WNT-β и MYC. Общая пятилетняя выживаемость для CMS2 опухолей всех стадий является самой высокой среди других подтипов. Кроме того, KPP второго подтипа чаще характеризуется поражением левой стороны поперечно-ободочной кишки (в 59%).
CMS3
Для данного типа характерен средний уровень микросателлитной нестабильности, он ниже, чем в CMS1, но выше, чем в CMS2 и CMS4. KRAS мутации могут встречаться в любом подтипе CMS, однако в CMS3 частота мутаций KRAS наиболее выражена (68%). Приблизительно в 3% случаев КРР CMS3 наблюдается амплификация гена HER2. Было высказано предположение, что предшественниками KPP с мутациями KRAS являются тубуло-ворсинчатые аденомы с чертами зубчатых полипов, т. е. смешанный гистологический вариант подтипов CMS1 и 2.
CMS4
В экспериментальных исследованиях опухоли данного подтипа развивались из зубчатых полипов на широком основании, как и опухоли первого подтипа. Развитие того или иного подтипа было связано с уровнем TGFβ. Для CMS4 характерен высокий уровень экспрессии данного белка. Опухоли данного подтипа характеризуются MSS. В отличие от микроокружения KPP подтипа CMS1, микроокружение опухоли CMS4 характеризуется присутствием Treg, Th17 и макрофагов. В 5% случаев КРР подтипа CMS4 наблюдается амплификация гена HER2. KPP данного подтипа CMS4 имеет плохой прогноз и худшую общую пятилетнюю выживаемость среди всех подтипов.
Таблица 1. Молекулярная классификация колоректального рака
|
Признак |
CMS1 |
CMS2 |
CMS3 |
CMS4 |
|
Предшественник |
Зубчатый полип |
Аденоматозный полип |
Тубовиллезные аденомы с чертами зубчатых полипов |
Зубчатый полип |
|
Локализация |
Проксимальные отделы толстой кишки (правая половина) |
В 59% левая половина толстой кишки |
Нет предпочтительной локализации |
Нет предпочтительной локализации |
|
Молекулярно-генетические особенности |
MSI |
MSS |
Мутации KRAS |
MSS |
|
Клинические особенности |
Рецидивы редки, после них прогноз хуже |
— |
— |
Характерны рецидивы, плохой прогноз |
Данная классификация в идеале позволит подходить индивидуально к лечению каждого пациента и поможет в подборе максимально эффективной терапии для того подтипа KPP, который есть у данного конкретного больного.
Заключение
Исследование молекулярно-генетических механизмов развития КРР не только помогло понять биологию и закономерности канцерогенеза данного типа опухолей, но также разработать ряд таргетных противоопухолевых препаратов. Молекулярно-генетическая классификация КРР до сих пор не вошла в международные и отечественные рекомендации, однако она может стать перспективным инструментом для стратификации пациентов и назначения рациональной системной терапии.
| Молекулярное тестирование | Препараты, одобренные на территории РФ, а также используемые в рамках клинических исследований (*) |
| Микросателлитная нестабильность | Анти-PD-1 терапия: пембролизумаб, ниволумаб; анти-PD-1+анти-CTLA-4 терапия: ниволумаб+ипилимумаб |
| KRAS | Анти-EGFR антитела: цетуксимаб, панитумумаб |
| NRAS | Анти-EGFR антитела: цетуксимаб, панитумумаб |
| BRAF | Анти-EGFR антитела: цетуксимаб, панитумумаб; ингибиторы BRAF, BRAF/MEK: вемурафениб, дабрафениб+траметиниб |
| HER2 | Анти-EGFR антитела: цетуксимаб, панитумумаб; анти-HER2 антитела: трастузумаб+пертузумаб |
Зеленый — чувствительность к терапии, Красный — резистентность к терапии.
| Ген | Краткая информация |
| Микросателлитная нестабильность (MSI) | • MSI является биологическим признаком не только наследственного неполипозного рака толстой кишки (синдром Линча), но также обнаруживается примерно в 19% спорадических случаев КРР. • КРР с наличием MSI имеют сниженную способность к метастазированию. • Наличие MSI у пациентов со II стадией заболевания связано с благоприятным прогнозом и с отсутствием доказанной эффективности применения адъювантной химиотерапии фторпиримидинами. • При этом, низкодифференцированная опухоль не является достоверным показателем высокого риска рецидивирования у пациентов со II стадией заболевания с наличием MSI. • Наличие MSI является показанием для назначения иммунотерапии у пациентов с метастатическим КРР. Показания: Рекомендовано всем пациентам с КРР для персонализации тактики ведения пациентов (NCCN, 2020). |
| Мутации в генах RAS | • Мутации в гене KRAS встречаются в 40% всех случаев КРР, а аберрации в гене NRAS- в 4-9% случаев (NCCN, 2020). • Наличие мутации в гене KRAS, NRAS ассоциировано с резистентностью к терапии анти-EGFR антителами, такими как цетуксимаб и панитумумаб, у пациентов с метастатическим КРР (RUSSCO, 2019; NCCN, 2020). Показания: Рекомендовано всем пациентам с метастатическим КРР для определения возможности применения анти-EGFR антител. |
| Мутация V600E в гене BRAF | • Данная мутация встречается в 5-9% всех случаев КРР. • Наличие мутации является причиной резистентности к терапии анти-EGFR антителами, такими как цетуксимаб и панитумумаб, у пациентов с метастатическим КРР (RUSSCO, 2019; NCCN, 2020). • BRAF V600E является негативным прогностическим маркером у пациентов с метастатическим КРР вне зависимости от терапии (ESMO, 2018). • BRAF-положительные пациенты имеют значительно ниже показатели общей выживаемости в сравнении с пациентами с наличием мутаций в гене KRAS или диким типом гена BRAF и KRAS (NCCN, 2020). • BRAF-положительные опухоли имеют характерный паттерн метастазирования: достоверно чаще отмечается перитонеальный карциноматоз, а также метастазирование в отдаленные лимфатические узлы (ESMO, 2018; Tran B. et al, 2011). Показания: Рекомендовано всем пациентам с метастатическим КРР для определения возможности применения анти-EGFR антител. При наличии BRAF V600E рекомендовано назначение BRAF-ингибитора у пациентов с метастатическим КРР. |
| Амплификация гена HER2 | • Общая распространенность амплификации гена HER2 составляет около 3%. • У пациентов с отсутствием мутаций в генах BRAF, KRAS, NRAS распространенность достигает от 5 до 14%. Показания: Рекомендовано обнаружение амплификации HER2 для определения возможности применения анти-HER2 терапии у пациентов с метастатической стадией заболевания (NCCN, 2020). |
Список литературы
- DeVita, Vincent T., Jr., Theodore S. Lawrence, and Steven A. Rosenberg. Devita, Hellman, and Rosenberg’s Cancer: Principles & Practice of Oncology. 11th edition. Philadelphia: Wolters Kluwer, 2019.
- Benson AB, Venook AP, Al-Hawary MM, Cederquist L, Chen Y-J, Ciombor KK, et al. NCCN Guidelines Insights: Colon Cancer, Version 2.2018. J Natl Compr Cancer Netw J Natl Compr Canc Netw 2018;16:359–69. doi:10.6004/jnccn.2018.0021.
- Singh MP, Rai S, Pandey A, Singh NK, Srivastava S. Molecular subtypes of colorectal cancer: An emerging therapeutic opportunity for personalized medicine. Genes Dis 2019. doi:10.1016/j.gendis.2019.10.013.
- Menter DG, Davis JS, Broom BM, Overman MJ, Morris J, Kopetz S. Back to the Colorectal Cancer Consensus Molecular Subtype Future. Curr Gastroenterol Rep. 2019;21(2):5. Published 2019 Jan 30. doi:10.1007/s11894-019-0674-9
- Serebriiskii IG, Connelly C, Frampton G, Newberg J, Cooke M, Miller V, et al. Comprehensive characterization of RAS mutations in colon and rectal cancers in old and young patients. Nat Commun 2019. doi:10.1038/s41467-019-11530-0.
- Ducreux M, Chamseddine A, Laurent-Puig P, et al. Molecular targeted therapy of BRAF-mutant colorectal cancer. Ther Adv Med Oncol. 2019;11:1758835919856494. doi:10.1177/1758835919856494
- Li, K., Luo, H., Huang, L. et al. Microsatellite instability: a review of what the oncologist should know. Cancer Cell Int 20, 16 (2020)
- Luchini C, Bibeau F, Ligtenberg MJL, Singh N, Nottegar A, Bosse T, et al. ESMO recommendations on microsatellite instability testing for immunotherapy in cancer, and its relationship with PD-1/PD-L1 expression and tumour mutational burden: A systematic review-based approach. Ann Oncol 2019. doi:10.1093/annonc/mdz116.
- Nojadeh JN, Behrouz Sharif S, Sakhinia E. Microsatellite instability in colorectal cancer. EXCLI J. 2018;17:159-168. Published 2018 Jan 22. doi:10.17179/excli2017-948