Рак тела матки
Рак тела матки (РТМ), является одним из наиболее распространенных типов опухолей женской репродуктивной системы. На долю РТМ приходится примерно 5% онкологической заболеваемости и 2% смертности среди женщин. Уровень заболеваемости продолжает расти: по оценкам, в 2018 г. в США было выявлено 63 230 случаев по сравнению с 47 130 в 2012 г. Наибольший уровень заболеваемости отмечается в Северной Америке и Восточной Европе, что связывают с особенностями населения стран с высоким уровнем дохода — распространенное ожирение, большая продолжительность жизни, более поздний возраст первых родов и меньшее количество родов.
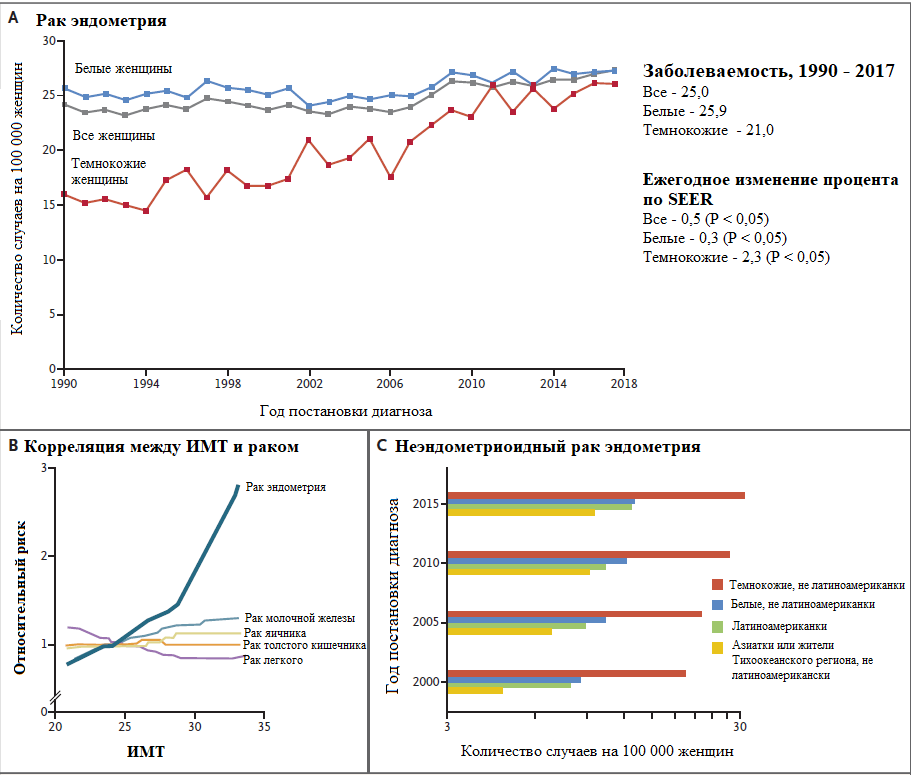
Пятилетняя выживаемость при данном заболевании коррелирует со стадией при постановке диагноза. У пациентов с локализованным РТМ 5-летняя выживаемость составляет ≥ 95%, однако показатель резко снижается в случае распространенного процесса: пациенты с метастазами в регионарных лимфоузлах – 69%, а с отдаленными метастазами – 17%. Большинство карцином эндометрия носят спорадический характер, однако существуют и наследственные случаи, связанные с герминативными мутациями в генах системе исправления ошибок репликации (mismatch repair system- MMR).
Понимание молекулярно-генетических механизмов патогенеза РТМ позволит улучшить современную гистологическую классификацию, усовершенствовать методы диагностики и обеспечит персонализацию лечения.
Современные системы классификаций
Клинико-патологическая классификация
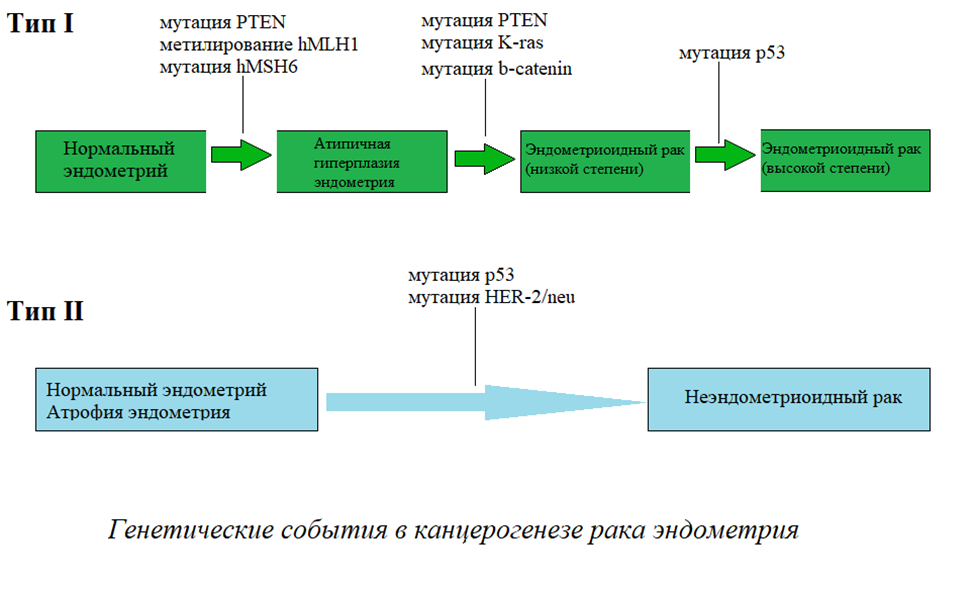
В зависимости от клинико-патологических особенностей рак эндометрия можно подразделить на два типа: тип I и тип II.
Тип I выявляется примерно в 80 % случаев рака эндометрия. Чаще всего развивается у женщин в пременопаузе или перименопаузе, возникая эстроген-зависимым образом через атипичную гиперплазию эндометрия. В основном это высокодифференцированная эндометриоидная аденокарцинома с относительно благоприятным прогнозом.
В то же время II тип развивается у женщин в постменопаузе эстроген-независимым образом и считается результатом канцерогенеза de novo, который развивается непосредственно из нормального эндометрия, а не на основе гиперплазии эндометрия в качестве его предшественника. Гистологически данный тип представлен низкодифференцированной эндометриоидной аденокарциномой и серозной карциномой и характеризуется неблагоприятным прогнозом. Однако до 10% случаев рака эндометрия не могут быть отнесены ни в первую, ни во вторую категории.
Гистологическая классификация и ее ограничения
С точки зрения морфологии принято выделять следующие виды злокачественных опухолей тела матки:
- Эндометриоидная аденокарцинома (75%) (вариант с плоскоклеточной метаплазией, виллогландулярный вариант, секреторный вариант);
- Cерозная карцинома (5-10%);
- Светлоклеточный рак (1-5%);
- Муцинозный рак (1%);
- Злокачественные смешанные опухоли Мюллерова протока или карциносаркомы (1-2%);
- Саркомы матки (лейомиосаркома, эндометриальная стромальная саркома, недифференцированная саркома) (3%);
- Недифференцированные опухоли.
Однако гистологические подтипы и определение степени часто пересекаются, например, эндометриоидная карцинома низкой степени дифференцировки (G3) схожа морфологически с серозной карциномой, что приводит к затруднениям в принятии клинического решения и выбора тактики. Из-за склонности серозных карцином к раннему метастазированию необходимо на ранних стадиях отдать предпочтение химиотерапии, в то время как при аналогичной стадии эндометриоидной карциномы G3 необходимо выбрать лучевую терапию. Таким образом, правильность определения подтипа существенно влияет на выбор лечения и его результаты. Более того, эндометриоидная карцинома G3 часто имеет общие паттерны иммуногистохимического окрашивания с эндометриоидной карциномой G1, такие как высокая экспрессия циклина D1 и низкая экспрессия HER2, но в то же время могут выявляться агрессивные особенности, такие как лимфоваскулярная инвазия и сниженная экспрессия рецепторов гормонов. Включение молекулярных детерминант для дифференциации степеней или подтипов может упростить классификацию и выбрать правильный подход к лечению.
Характеристика рака эндометрия с использованием иммуногистохимических маркеров, включая p53, PTEN, ER (рецептор эстрогена), PR (рецептор прогестерона) и другие, помогает дифференцировать подтипы. Молекулярные особенности и генетические изменения, связанные с основными клинико-гистологическими категориями, дополнительно уточняют это различие (Таблица №1). Гистологическая классификация предоставляет важную прогностическую информацию и полезна при выборе тактики хирургического лечения, а также системной терапии. Однако существующую систему можно улучшить путем включения молекулярных детерминант.
Молекулярная классификация
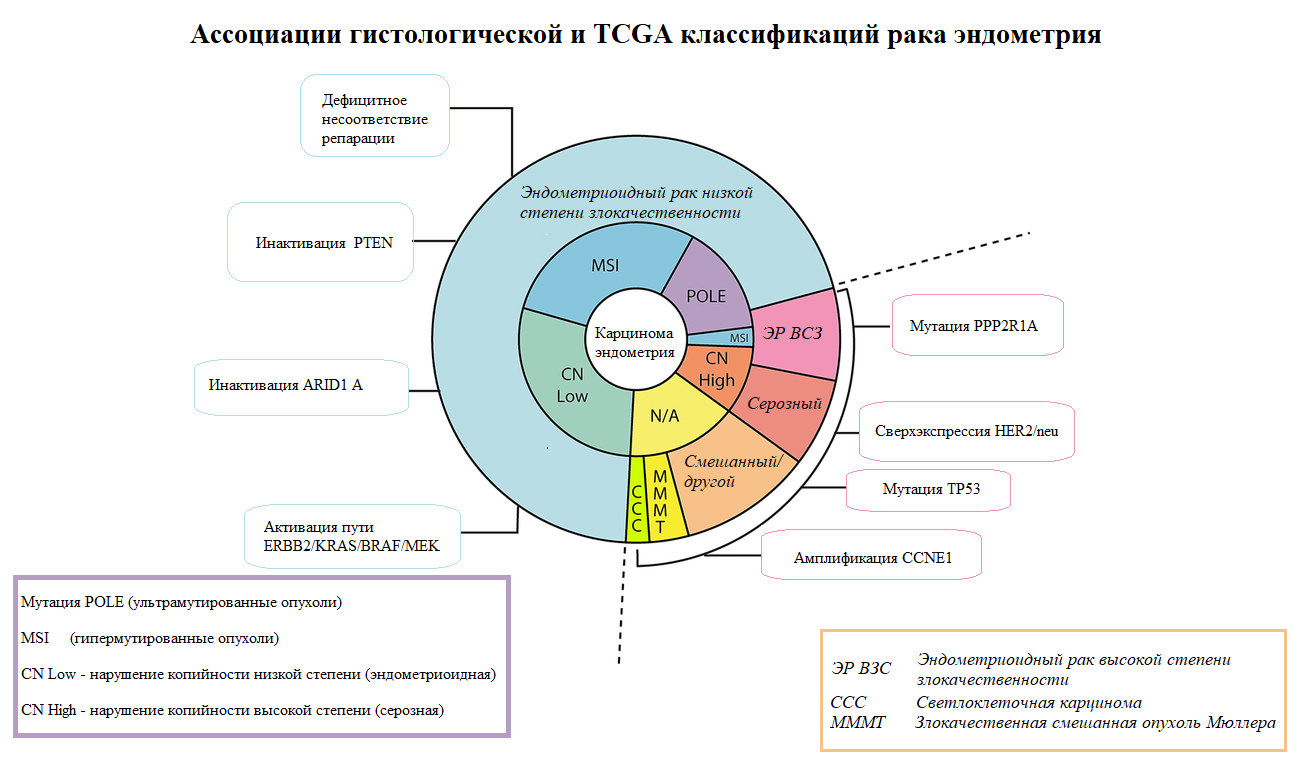
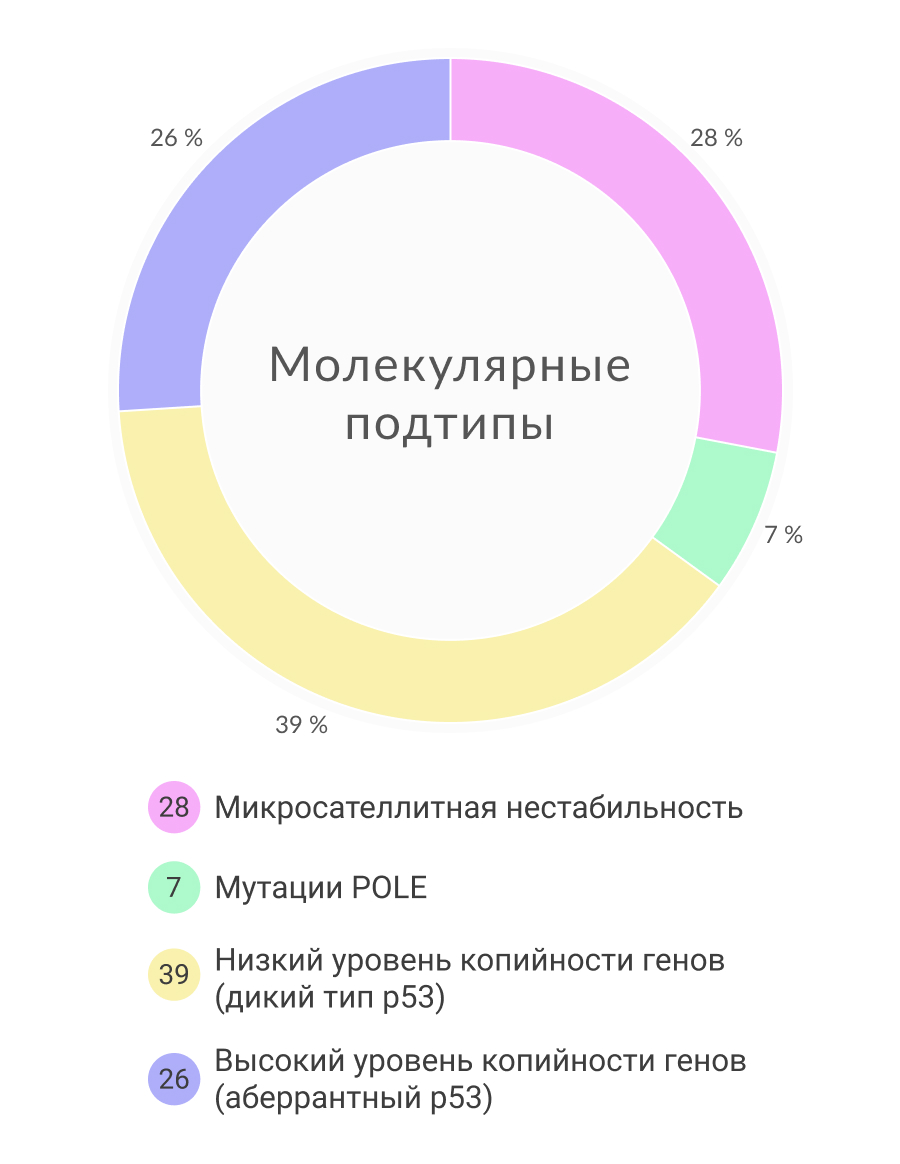
В 2013 году Атлас ракового генома (The Cancer Genome Atlas, TCGA — проект Национального института рака по созданию классификации различных типов рака на геномном уровне) предоставил данные крупномасштабного исследования 373 образцов карцином эндометрия, которое включало анализ последовательности экзома, анализ последовательности транскриптома, анализ числа копий генома, определение микросателлитной нестабильности и профиля метилирования. В результате были выделены четыре категории карцином эндометрия с четкими клиническими, патологическими и молекулярными особенностями:
- Мутация POLE (ультрамутированные опухоли) – 7%
- MSI (гипермутированные опухоли) – 28%
- Нарушение копийности низкой степени– 39%
- Нарушение копийности высокой степени — 26%
`
Рисунок 3. Молекулярная классификация.
Эти подгруппы TCGA и связанные с ними молекулярные изменения коррелируют и подразделяют гистологические подгруппы карцином эндометрия.
Мутации POLE
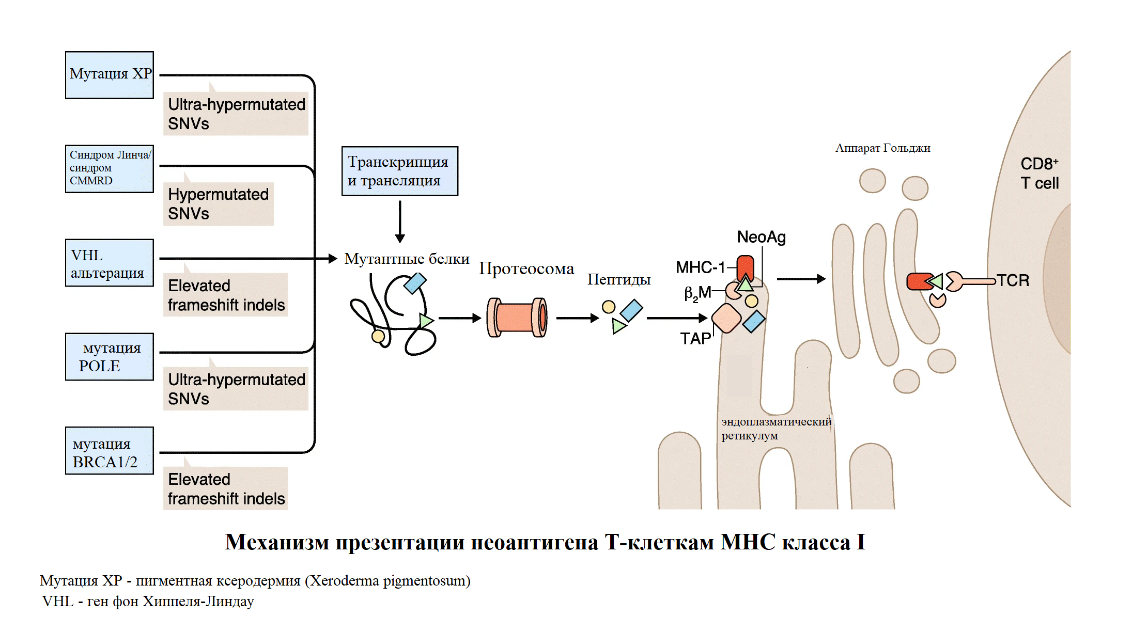
Ультрамутантный подтип (наличие мутаций в гене POLE) – это подгруппа, характеризующаяся соматическими мутациями в домене экзонуклеазы полимеразы-эпсилон-ДНК-полимеразы (POLE). Дефект в данном гене обеспечивает чрезвычайно высокий уровень мутаций, приводящий к увеличению продукции «неоантигенов» (то есть опухольспецифических пептидов, которые могут распознаваться иммунной системой как чужеродные, превращая опухолевые клетки в мишени для разрушения) и, как следствие, активации иммунной системы.
Неоантигены возникают в результате соматических изменений, включая точечные мутации, приводящие к транскрипции и трансляции «новых» пептидных последовательностей. Когда эти уникальные для опухоли белки подвергаются протеолизу в протеасоме, полученные пептиды импортируются в эндоплазматический ретикулум (ER) с помощью белка TAP (транспортера, связанного с процессингом антигена). Далее неоантигенный пептид (NeoAg; зеленый треугольник) прочно связывается с комплексом, включающим белок MHC-I и бета-2-микроглобулин (β2M), и экспортируется на поверхность клетки через аппарат Гольджи. Неоантиген, связанный с MHC, представлен на поверхности клетки, где он может взаимодействовать с CD8+ T-клетками, которая экспрессирует соответствующий T-клеточный рецептор (TCR) (рисунок 3). Взаимодействие между CD8+ Т-клетками и неоантигенами вызывает специфическое для Т-клеток распознавание каждого «чужого» неоантигенного пептида, тем самым позволяя иммунной системе пациента отличать опухолевые клетки от нормальных.
Подгруппа POLE состоит из эндометриоидных карцином низкой и высокой степени злокачественности. Важно отметить, что POLE-ассоциированный РТМ характеризуется благоприятным прогнозом, в частности редким рецидивированием. Данный парадокс, возникший между агрессивными гистопатологическими особенностями опухоли и высокими показателями выживаемости, может частично объясняться высокой неоантигенной нагрузкой и богатым иммунным микроокружением опухолей с мутациями в гене POLE.
Зачастую адъювантное лечение у данного молекулярного подтипа опухолей, в частности при эндометриоидных карциномах, проводится в связи с наличием гистологических признаков «высокого риска»: низкая степень дифференцировки, глубина инвазии в миометрий (>1/2), лимфоваскулярная инвазия. Однако пока неясно, является ли это чрезмерным лечением у женщин с POLE-положительными опухолями или же благоприятный прогноз является вторичным по отношению к высокой чувствительности к агентам, повреждающим ДНК в этих опухолях.
Микросателлитная нестабильность (MSI)
Микросателитная нестабильность среди всех молекулярных подтипов РТМ присутствует в 28% случаев. Микросателлиты – это повторяющиеся последовательности ДНК, состоящие из коротких нуклеотидных сегментов (2-6 нуклеотидов, также называемые короткими тандемными повторами). Из-за своей повторяющейся природы эти фрагменты ДНК склонны к увеличению своей последовательности в результате проскальзывания ДНК-полимеразы во время репликации. Система репарации ДНК MMR (mismatch repair system) осуществляет проверку вновь реплицированной цепи и исправление ошибок, в частности, изменения последовательности микросателлитов. Феномен изменения размера повторяющихся последовательностей ДНК, а именно их увеличение, называется микросателлитной нестабильностью (MSI).
MSI возникает в результате герминативных либо соматических мутаций в генах системы репарации ДНК (MMR). Герминативные мутации одного из генов MMR (MLH1, MSH2, MSH6 или PMS2) или делеция стоп-кодона гена EPCAM являются причиной синдрома Линча (наследственный неполипозный рак толстой кишки), имеющий аутосомно-доминантный характер наследования. Кроме того, эпигенетические изменения могут подавлять экспрессию генов MMR. Такие изменения включают в себя гиперметилирование промотерного региона гена MLH1, эпигенетическую инактивацию MSH2 или подавление генов MMR с помощью микроРНК. Спорадический дефект системы MMR чаще всего обусловлен гиперметилированием промоторной области MLH1. Опухолевые клетки с дефектом системы MMR накапливают мутации в повторяющихся последовательностях, микросателлитах, расположенных в генах, регулирующих клеточный рост, апоптоз, репарацию ДНК. К таким генам относятся TGFbeta RII, IGFIIR и BAX. Появление микросателлитной нестабильности в данных генах приводит к их инактивации, либо к сдвигу рамки считывания и, как следствие, появлению неоантигенов.
Подобно подгруппе POLE, подгруппа MSI-положительных опухолей представляет собой исключительно эндометриоидные опухоли G1–3. Для опухолей с MSI характерны мутации ARID5B, мутации PTEN и мутации в генах семейства фосфатидилинозитол-3-киназ, включая PIK3CA и PIK3R1. Данные о взаимосвязи MSI-ассоциированных опухолей эндометрия и клиническим исходом пациентов различных исследований противоречат друг другу, что вероятнее всего отражает различия в размере когорт, включении гистотипа и методики для оценки MSI. Однако в недавнем крупном исследовании, которая включила более чем 1000 эндометриоидных карцином, продемонстрирована статистически значимая связь между статусом MMR и неблагоприятными клинико-патологическими характеристиками. В частности, эпигенетические дефекты MMR и соматические мутации в генах системы MMR были связаны с более низкой степенью дифференцировки опухоли и наличием инвазии в лимфоваскулярное пространство; эпигенетические дефекты MMR также были связаны с распространенностью заболевания: наличие III / IV стадии.
Нарушение копийности высокой и низкой степени
Исследование TCGA также выявило две отдельные молекулярные подгруппы на основе изменений числа копий: подгруппа с нарушением копийности низкой степени (CN Low), на долю которой приходится 39 %, и подгруппа с нарушением копийности высокой степени (CN High) – 26 %. Группа с низким уровнем CN включает более половины эндометриоидных опухолей низкой степени злокачественности. И наоборот, почти все серозные карциномы (97,7%) и большинство карцином смешанного типа (75%) относятся к подгруппе CN high. Эти данные согласуются с известной анеуплоидией и хромосомной нестабильностью, типичной для серозных карцином. В целом, опухоли в подгруппе CN high имеют наименее благоприятный прогноз среди четырех молекулярных подгрупп.
Интегрированная генетическая классификация РТМ
Следует отметить, что одной из характеристик молекулярной классификации является определение прогностического риска при каждом из видов мутаций. Однако методики, использованные в исследовании TCGA, были дорогостоящими, сложными и непригодными для более широкого клинического применения, поэтому две другие исследовательские группы, разработали более практически применимые методики оценки молекулярных характеристик РТМ.
Прогностическая значимость молекулярной классификации TCGA подтверждена исследователями Ванкувера (ProMisE/Vancouver) и Голландским рандомизированным исследованием (Leiden/TransPORTEC) на больших когортах.
Уточнение молекулярной классификации группой Leiden/TransPORTEC привело к формированию четырех молекулярных подгрупп: группа 1 — p53, группа 2 — MSI, группа 3 — POLE и группа 4 –NSMP, группа без «специфического молекулярного профиля». Было установлено, что подгруппы POLE и MSI характеризовались более благоприятным прогнозом и продемонстрировали значительно более высокую инфильтрацию иммунными клетками и экспрессию PD-1 и PD-L1, что может служить точкой приложения иммунотерапии. Кривые выживаемости у двух других подгрупп — «TP53» и «NSMP» — были схожие и ассоциированы с наличием рецидивов и отдаленных метастазов.
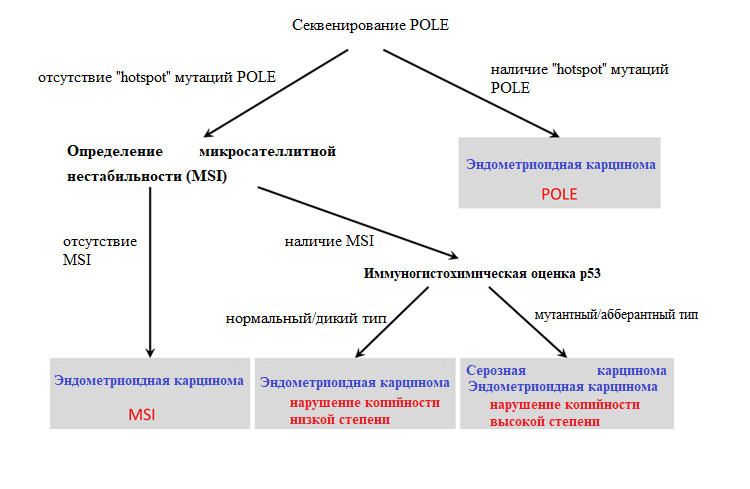
Другая исследовательская группа ProMisE/Vancouver – ProMisE (Proactive Molecular Risk Classifier for Endometrial Cancer) установила, что первоочередно необходимо определить наличие микросателлитной нестабильности (MSI). Данная информация позволит быстро направить женщин в программу лечения наследственного рака и генетическое консультирование. Затем опухоли оцениваются на предмет мутаций экзонуклеазного домена полимеразы — (POLE) и, наконец, на предмет абберантной экспрессии p53 с помощью ИГХ, в результате чего выделяются 4 подгруппы: MMR, POLE, p53 дикого типа (p53 wt) и абберантный p53 (p53 abn). Было установлено, что опухоли подгруппы «POLE» имеют наиболее благоприятный прогноз, а опухоли «p53 abn» — наихудший.
Однако, у алгоритмов ProMisE/Vancouver и Leiden/TransPORTEC есть некоторые ограничения. Результаты иммуногистохимической оценки р53 не полностью коррелируются с аберрациями гена ТР53. Следовательно, данный показатель в данных алгоритмах может привести к неверному классифицированию опухолей с нарушением копийности высокой степени. Также алгоритмы не применимы для стратификации опухолей, содержащих более одной генетической аберрации (мутации POLE, мутации в генах MMR или мутации P53), при их параллельном, а не последовательном выявлении. Алгоритмы не позволяют исследовать значимую неоднородность, наблюдаемую в группе с нарушением копийности низкой степени. Кроме прочего, в алгоритме ProMisE генетическая оценка MMR выполняется перед секвенированием POLE, что может привести к невозможности обнаружить опухоли, обладающие мутацией как в гене MMR, так и в гене POLE, а также к неправильной стратификации данных опухолей — подтип MSI, а не как опухоль подтипа POLE. Таким образом вернее будет выполнить секвенирование POLE перед выявлением аберраций в генах MMR.
Однако не смотря на эти ограничения, интегрированная схема генетико-патоморфологической классификации, включающая стратификацию на основе молекулярных альтераций с традиционными и клинико-патологическими прогностическими параметрами, представляет собой наиболее доступный метод для разделения пациентов на прогностически разные группы для обеспечения персонализации лечения.
Ген TP53
Белок p53 регулирует пролиферацию клеток, индукцию апоптоза и репарацию ДНК. Гиперэкспрессию мутантного р53 связывают с признаками неблагоприятного прогноза, такими как распространенность заболевания, высокая степень злокачественности и неэндометриоидный гистотип. Точечные мутации в гене TP53 обнаруживаются в 90 % случаев рака эндометрия II типа, в 10–20 % случаев рака эндометрия I типа. Также данные мутации обнаруживается в 10 % случаев опухолей I и II стадии и в 40 % случаев рака III и IV стадии.
В 2016 году Schultheis et al. описал спектр мутаций TP53 при РТМ как в контексте гистотипа, так и по отношению к молекулярной классификации TCGA. Это исследование отобразило распространенность мутаций TP53 в подтипе «CN high», что составило 91% всех случаев. Также было отмечено наличие данной аберрации в 35% случаев POLE-ассоциированного РТМ. Данные ряда других исследований подтверждают благоприятный прогноз у пациентов с наличием мутации POLE даже при условии наличия мутаций в других генах, которые традиционно связаны с высоким риском рецидива.
Гены BRCA1/2
Широко известно, что наследуемые мутации в генах BRCA1 и BRCA2 приводят к значительному увеличению риска рака молочной железы и яичников, а также к меньшему, но также значительно повышенному риску некоторых других видов рака. Папиллярная серозная карцинома является наиболее распространенным гистологическим подтипом рака яичников, ассоциированного с мутацией BRCA, а серозная карцинома матки также имеет связь с раком молочной железы. Было показано, что герминативные мутации в гене BRCA1/2 способны увеличивать риск развития РТМ.
BRCA1 и BRCA2 — это гены-супрессоры опухолей, расположенные на хромосомах 17q21 и 13q12, соответственно. Белки BRCA1 и BRCA2 участвуют в поддержании стабильности генома посредством репарации двухцепочечных разрывов ДНК (DSB) посредством гомологичной рекомбинации (HRR), регуляции клеточного роста и контроле клеточного деления.
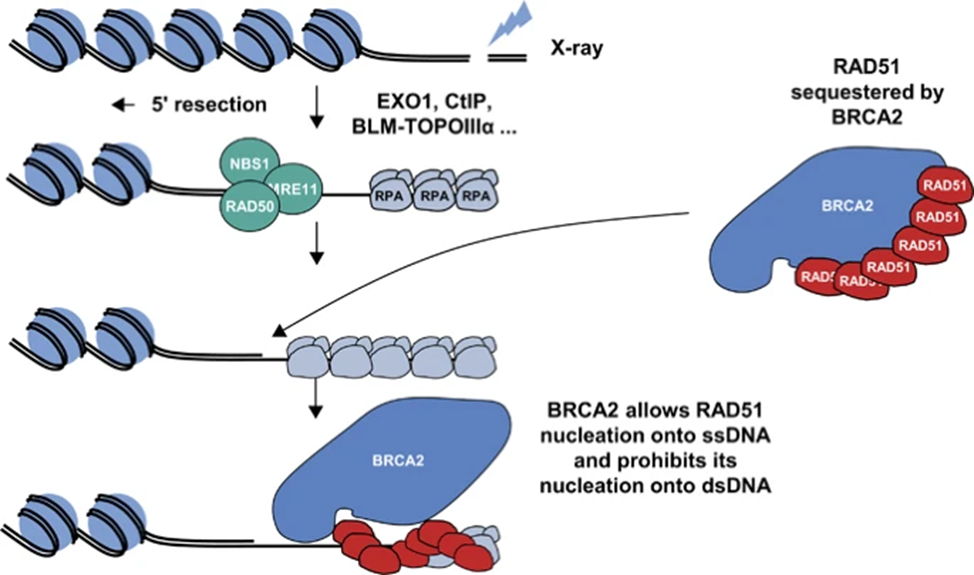
BRCA1 и BRCA2 являются ключевыми компонентами HRR и клетки, лишенные этих белков, не способны восстанавливать двухцепочечные разрывы ДНК (DSB), которые являются наиболее опасным типом повреждения ДНК. Если не происходит репарации либо она протекает неправильно, DSB могут привести к геномным перестройкам или гибели клеток. Гомологичная рекомбинация является высококонсервативным путем, который обеспечивает точную репарацию DSB на поздних фазах S и G2 клеточного цикла с использованием интактной сестринской хроматиды в качестве матрицы для восстановления разрыва и поддержания целостности последовательности.
BRCA1 играет раннюю и основную роль в регулировании HRR. Было показано, что BRCA1 сгруппировывается на участках повреждения ДНК с RAD51, другим ключевым белком, участвующим в HRR. Центральная роль другого белка BRCA2 в HRR была впервые отмечена после обнаружения факта, что приобретенные хромосомные аномалии BRCA2-дефицитных клеточных линий аналогичны тем, которые наблюдаются при анемии Фанкони, поэтому BRCA2 зачастую упоминают как FANCD1.
В настоящее время широко доступны методы выявления патогенных мутаций BRCA1 и BRCA2. Однако до сих пор основной целью тестирования на наличие данной аберрации была оценка риска для ранней диагностики и профилактики рака, но сейчас становится все более очевидным тот факт, что знание статуса BRCA имеет предиктивную ценность, которая может повлиять на тактику лечении и улучшить выживаемость.
Считается, что два гена являются синтетически летальными, если мутация в одном только гене совместима с жизнеспособностью клеток, но одновременная мутация обоих генов вызывает гибель клеток. Это предполагает, что ингибирование дополнительного пути репарации повреждений ДНК, вероятно, будет синтетически летальным для клеток, лишенных HRR, будь то из-за патогенных герминативных или соматических мутаций BRCA1/2, посттрансляционных изменений BRCA или альтераций других генов, участвующих в HRR.
Другим путем репарации ДНК считается путь, контролируемый поли-АДФ-рибоза-полимеразой (PARP). Наиболее распространенным представителем данной группы является белок PARP1, который действует как «молекулярный датчик» одноцепочечных разрывов, сигнализируя о них. PARP1 активируется при их обнаружении и связывании с областями повреждений посредством своего ДНК-связывающего домена, имеющий структуру «цинкового пальца». Потеря функциональности PARP приводит к накоплению в клетке одноцепочечных разрывов ДНК, которые в результате дальнейшей транскрипции и репликации превращаются в двуцепочечные, восстановлением которых должна заниматься. Следовательно, отсутствие репарации посредством HRR и накопление разрывов приводит к последующей гибели клеток.
Знание аллельного статуса изменений BRCA1/2 и/или признаков дефицита HRR может быть полезным при принятии решений, касающихся терапии. BRCA1/2 являются клинически подтвержденными биомаркерами для использования PARP ингибиторов, которые последние несколько лет показали себя, как многообещающую таргетную терапию при опухолях женской репродуктивной системы. Механизм действия данной группы заключается в блокировке каталитической активности фермента PARP, что предотвращает репарацию, репликацию и транскрипцию ДНК в атипичных клетках, содержащих мутации BRCA1/2, и направляет их в апоптоз. А поскольку было обнаружено, что повреждения ДНК приводят к увеличению экспрессии лиганда PD-L1, комбинация PARP ингибиторов с анти-PD-1/PD-L1 антителами является многообещающей стратегией у пациентов с РТМ. В настоящее же время проводится несколько клинических испытаний фазы I и II, в которых оценивается роль PARP ингибиторов (олапариб, нирапариб, рукапариб и талазопариб) при метастатическом, прогрессирующем и рецидивирующем РТМ как отдельно, так и в комбинации с другими препаратами.
Генетическая предрасположенность к РТМ
Семейный рак тела матки, возникающий в результате наследственной генетической предрасположенности, выявляется примерно в 5 % случаев. Большинство унаследованных видов возникает в связи с синдромом Линча, высокопенетрантного аутосомно-доминантного наследственного опухолевого синдрома, вызванного за счет герминативных мутаций в генах MMR (MLH1, MSH2, MSH6 или PMS2) или герминативных делеций, охватывающей область EpCAM, которая приводит к эпигенетическому подавлению соседнего гена MSH2. Это один из наиболее распространенных наследственных онкологических синдромов с оценочной заболеваемостью в популяции 1: 370. Риск развития РТМ на протяжении жизни составляет 25-60 %. При этом средний возраст постановки диагноза приходится на 48–62 года. С точки зрения гистологии рак тела матки, развивающийся в результате синдрома Линча, разнообразен, наибольшая доля случаев представлена эндометриоидным раком (56–96 %), в то же время серозные, светлоклеточные, смешанные, муцинозные, недифференцированные карциномы и карциносаркомы встречаются значительно реже.
Помимо повышенного риска РТМ, пациенты с синдромом Линча также подвержены риску колоректального рака, рака яичников, желудка, тонкой кишки, молочной железы и простаты, а также рака гепатобиллярного тракта, мочевыводящих путей, поджелудочной железы. Важно отметить, что РТМ называют «дозорным», так как он часто является предшественником колоректальному раку. Таким образом, универсальное тестирование новообразований эндометрия на MSI с последующим анализом метилирования промотора MLH1 может быть использовано для выявления потенциальных лиц с синдромом Линча для последующего подтверждения путем генетического тестирования.
Помимо синдрома Линча наследственная предрасположенность к раку эндометрия отмечается при полипозе, ассоциированном с POLD1-полимеразой, и PTEN-ассоциированным синдромом Коудена, при котором риск рака эндометрия у носителей мутации PTEN составляет от 19% до 28% (Таблица №2).
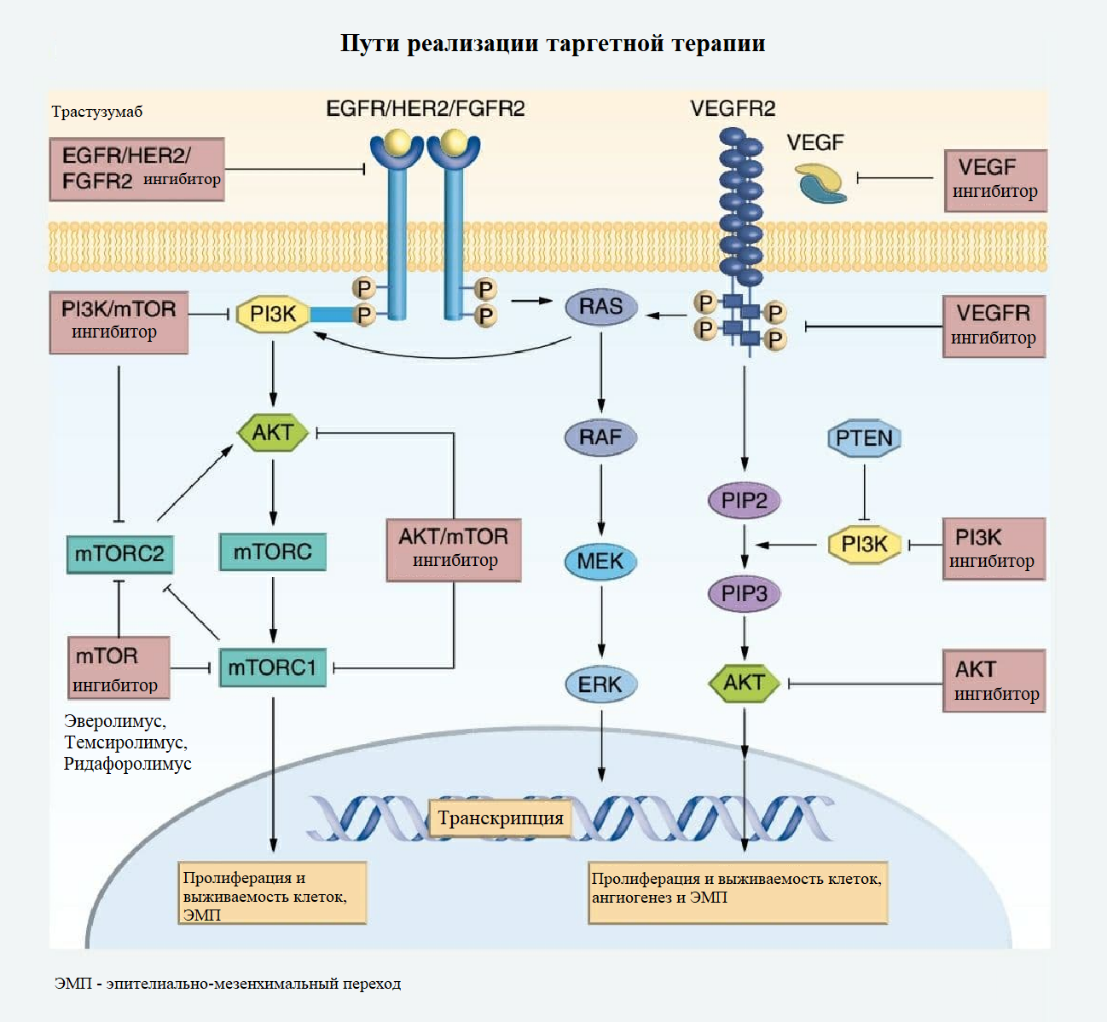
Молекулярные изменения определяют потенциальные таргетные терапевтические мишени
Молекулярное тестирование для персонализации терапевтического подхода с каждым днем становится обыденнее. В последние годы для лечения рака эндометрия были оценены множественные таргетные методы лечения, и некоторые из них недавно получили одобрение FDA (Food and Drug Administration — управление по санитарному надзору за качеством пищевых продуктов и медикаментов). Общие изменения в молекулярных сигнальных путях рака эндометрия имеют хорошо известное функциональное влияние на опухолевую ДНК, пролиферацию клеток и клеточную инвазию. Они предоставляют потенциальные таргетные подходы в лечении рака эндометрия.
Гормональная терапия
Гормональная терапия часто рассматривается для лечения рецидивирующего метастатического рака эндометрия или в качестве начальной терапии у пациентов, для которых циторедуктивная хирургия и цитотоксическая химиотерапия невозможны. Характеристики, благоприятные для ответа на гормональную терапию, включают эндометриоидные опухоли G1/2, экспрессию рецептора эстрогена (ER) и рецептора прогестерона (PR), а также низкая тяжесть болезни. Экспрессия ER / PR является часто используемым индикатором для гормональной терапии, однако опухоли с отрицательной экспрессией ER / PR могут также отвечать на данный вид лечения.
HER2 / Neu
HER2/neu представляет собой мембранный рецептор тирозинкиназы в семействе рецепторов эпидермального фактора роста, и амплификация этого онкогена, приводящая к гиперэкспрессии HER2, является наиболее распространенным видом мутации при серозной карциноме эндометрия и считаются неблагоприятным прогностическим показателем. В настоящее время для таких типов опухолей применяется трастузумаб, гуманизированное моноклональное антитело против HER2. Данная терапия была связана с благоприятными исходами при рецидивирующей, метастатической или прогрессирующей серозной карциноме матки. Недавно проведенное многоцентровое проспективное рандомизированное клиническое исследование фазы II показало увеличение выживаемости без прогрессирования заболевания при добавлении трастузумаба к химиотерапии на основе паклитаксела / карбоплатина.
Ингибиторы контрольных точек иммунитета
Ингибитор контрольной точки иммунитета, моноклональное антитело против PD-1, оказался в центре внимания исследований из-за первых успехов в лечении нескольких типов рака. Пембролизумаб, препарат против PD-1, получил одобрение FDA для лечения рецидивирующих опухолей с дефицитом MMR/MSI. Дефицит MMR либо наличие MSI связаны с увеличением количества мутаций и, как следствие, с более высокой неоантигенной нагрузкой, что приводит к увеличению инфильтрации опухоли цитотоксическими Т-клетками. Ожидается, что опухоли, несущие мутации POLE, также будут иметь благоприятный ответ из-за сверхвысокой мутационной нагрузки.
Ориентация на путь PI3K-AKT-mTOR
Изменения PI3K и mTOR в сигнальном пути характерны для РТМ, что приводит к аберрантной пролиферации клеток, усилению синтеза белка и ангиогенезу. Аберрации данных генов встречаются в 36% случаев рака эндометрия. Ингибиторы mTOR, такие как эверолимус, темсиролимус и ридафоролимус, показали умеренную клиническую эффективность при данном заболевании и продолжают изучаться. Комбинации ингибиторов mTOR и других агентов (например, темсиролимуса и бевацизумаба) показали некоторую активность, но также связаны со значительной токсичностью. Недавно исследование GOG 3007 показало, что комбинация эверолимуса и летрозола улучшает выживаемость без прогрессирования, особенно у пациентов с рецидивирующим раком эндометрия, не получавших ранее химиотерапию.
Развивающая терапия для ARID1A-мутированных опухолей
ARID1A (AT-богатый интерактивный домен 1A, также известный как BAF250A) является членом комплекса Switch/Sucrose (SWI / SNF), подсемейства АТФ-зависимых комплексов ремоделирования хроматина. ARID1A является наиболее часто мутирующим геном среди всех генов ремоделирования хроматина. Инактивирующие мутации данного гена зачастую обнаруживаются в широком спектре злокачественных новообразований, в том числе при эндометриоидных карциномах эндометрия. Наиболее важным механизмом действия является проявление синтетической летальности в опухолевых клетка с мутацией ARID1A с сопутствующими мутациями других генов. Например, данное генетическое событие в совокупности с мутацией в гене гистон-метилтрансферазы EZH2 приводит к повышению чувствительность атипичных клеток к терапии ингибитором EZH2. Точно также данная аберрация способствует сенсибилизации опухолевых клеток к ингибитору PARP и обычным химиотерапевтическим препаратам из-за своей роли в репарации повреждений ДНК.
Заключение
Учитывая значимую долю случаев РТМ среди всех онкологических заболеваний, ведение пациентов требует получения генетического профиля, чтобы наиболее точно оценить прогноз и обеспечить персонализацию лечения. Выявление молекулярно-генетических изменений является одним из новых инструментов в диагностике и лечении рака тела матки. Данные научных исследований постоянно накапливаются и обновляются, предоставляя информацию о новых особенностях патогенеза заболевания, новых точках приложения таргетной терапии и специфических маркерах для ранней диагностики.
Таблица №1: Гистологическая характеристика карциномы эндометрия.
|
Гистология |
Эндометриоидная карцинома LG |
Эндометриоидная карцинома HG |
Серозная карцинома |
Светлоклеточная карцинома |
|
Предраковое состояние |
Атипичная гиперплазия эндометрия |
Атипичная гиперплазия эндометрия |
Серозная интраэпителиаль-ная карцинома эндометрия |
Неизвестно |
|
Мутировавшие гены |
ARID1A, PTEN, KRAS, PIK3CA, CTNNB1, MLH1, MSH2, MSH6, PMS2 |
ARID1A, PTEN, KRAS, PIK3CA, CTNNB1, MLH1, MSH2, MSH6, PMS2, TP53 |
TP53, FBXW7, CCNE, HER2, p16 |
TP53, PTEN, ARID1A, PIK3CA |
|
TCGA |
Мутация POLE, MSI-H, нарушение копийности низкой степени |
Мутация POLE, MSI-H, нарушение копийности высокой степени |
Нарушение копийности высокой степени |
Нет данных |
Таблица №2: Известные причины наследственного рака эндометрия.
|
Генетический синдром |
Ген |
Риск рака эндометрия |
Другие сопутствующие возможные злокачественные опухоли |
|
Синдром Линча |
MLH1, MSH2, MSH6, PMS2, EPCAM del. |
27 – 71% Высокий риск |
Колоректальный рак (52–82%), Рак желудка (6–13%) Рак яичников (4–12%), тонкой кишки, кожи и гепатобиллиарной системы. |
|
Синдром Каудена |
PTEN |
19 – 28% Высокий риск |
Колоректальный рак, рак молочной железы, щитовидной железы. |
|
Синдром Пейтца — Йегерса
|
STK11/ LKB1 |
9% |
Колоректальный рак, рак поджелудочной железы, молочной железы, яичников и др. |
|
Синдром наследственного рака молочной железы – яичников |
BRCA1, BRCA2 |
Вероятно, умеренный риск (двоякий) |
Рак молочной железы, яичников предстательной железы, поджелудочной железы, брюшины, меланома. |
|
Полипоз, ассоциированный с POLD1-полимеразой |
POLD1, POLE |
Неизвестно, умеренный/ высокий риск |
Колоректальный рак, рак желудка и др. |
Таблица № 3: Сводная информация о гистологическом, молекулярном профиле и возможных вариантах лечения.
|
Гистотип |
Молекулярные изменения |
Лечение |
|
Серозная |
Экспрессия / амплификация Her2 Экспрессия андрогеновых рецепторов, ER, PR Мутация TP53
|
HER2-направленная терапия Гормональная терапия и антиандрогены Wnt-направленный ингибитор и платиночувствительная терапия |
|
Карциносаркома |
Экспрессия PD-1 и PD-L1
Мутация BRCA1 / 2
|
Иммунотерапия, направленная на PD1 / PDL-1 Ингибиторы платины и PARP-направленный ингибитор |
|
Светлоклеточная карцинома |
Экспрессия / амплификация Her2 Экспрессия C-Met Мутация ERBB2
Мутация BRCA1 |
HER2-направленная терапия Ингибиторы C-Met Ингибиторы рецепторов тирозинкиназы Ингибитор PARP |
|
Эндометриоидная аденокарцинома |
Рецепторы эстрогена и прогестерона Мутация PI3KCA PD-L1
Мутация BRCA2 |
Гормональная терапия и антиэстрогены Ингибиторы PI3K потери PTEN Иммунотерапия, направленная на PD1 / PDL-1 Ингибиторы платины и PARP |
| Молекулярное тестирование | Препараты, одобренные на территории РФ, а также используемые в рамках клинических исследований (*) |
| Микросателлитная нестабильность | Анти-PD-1 антитела: пембролизумаб |
| HER2 | Анти-HER2 антитела: трастузумаб* |
Зеленый — чувствительность к терапии, Красный — резистентность к терапии.
Группы риска при раке тела матки (ESGO/ESTRO/ESP, 2020)
|
Группа риска |
Молекулярная классификация известна * |
|
Низкий |
· Стадия I-II: POLE-ассоциированная карцинома эндометрия, без остаточной болезни; · Стадия IA: MSI/NSMP-ассоциированная эндометриоидная карцинома + низкой степени злокачественности (G1-2) + LVSI отсутствует или очаговая. |
|
Промежуточный |
· Стадия IВ: MSI/NSMP-ассоциированная эндометриоидная карцинома + низкой степени злокачественности (G1-2) + LVSI отсутствует или очаговая; · Стадия IA: MSI/NSMP-ассоциированная эндометриоидная карцинома + высокой степени злокачественности (G3) + LVSI отсутствует или очаговая; · Стадия IА: p53abn-ассоциированная карцинома и/или неэндометриоидный рак (серозная карцинома, светлоклеточная карцинома, недифференцированная карцинома, карциносаркома, смешанная) без инвазии в миометрий. |
|
Промежуточный — высокий |
· Стадия I: MSI/NSMP-ассоциированная эндометриоидная карцинома + существенная LVSI независимо от степени и глубины инвазии; · Стадия IB: MSI/NSMP-ассоциированная эндометриоидная карцинома высокой степени злокачественности (G3) независимо от статуса LVSI; · Стадия II: MSI/NSMP-ассоциированная эндометриоидная карцинома. |
|
Высокий |
· Стадия III-IVA: MSI/NSMP-ассоциированная эндометриоидная карцинома без остаточной болезни; · Стадия I-IVA: p53abn-ассоциированная эндометриоидная карцинома с инвазией в миометрий, без остаточной болезни; · Стадия I-IVA: MSI/NSMP-ассоциированная серозная, недифференцированная карцинома, карциносаркома с инвазией в миометрий, без остаточной болезни. |
|
Распространенный метастатический |
· Стадия III-IVA с остаточной болезнью любого молекулярного типа; · Стадия IVB любого молекулярного типа. |
LVSI: лимофваскулярная инвазия
p53abn: аномальная экспрессия р53, MSI: микосателлитная, NSMP: неспецифический молекулярный профиль, POLE: мутации в гене POLE.
* Для стадии III-IVA POLE-ассоциированной карциномы эндометрия и стадии I-IVA MMRd/NSMP-ассоциированной светлоклеточной карциномы без инвазии в миометрий недостаточно данных, чтобы отнести эти группы пациентов к какой-либо прогностической группе риска по молекулярной классификации. Рекомендуются перспективные реестры.
| Ген | Краткая информация |
| Микросателлитная нестабильность (MSI) |
• Определение MSI рекомендовано всем пациентам с РТМ для установления молекулярного подтипа опухоли с целью персонализации лечения. Показание: Рекомендовано пациентам с с рецидивирующим и метастатическим РТМ для определения показаний к проведению иммунотерапии анти-PD1 антителами (NCCN, 2021). |
| Амплификация гена HER2 |
• Распространенность амплификации гена HER2 при серозной карциноме эндометрия составляет около 35%. Показание: Рекомендовано всем пациентам с рецидивирующей, метастатической серозной карциномой эндометрия для определения показаний к применению анти-HER2 терапии. |
| Мутации в гене POLE |
• Распространенность мутаций в гене POLE составляет около 7%. Показание: Рекомендовано всем пациентам с раком тела матки для молекулярной классификации заболевания с целью персонализации лечения. |
Список литературы
- DeVita, Vincent T., Jr., Theodore S. Lawrence, and Steven A. Rosenberg. Devita, Hellman, and Rosenberg’s Cancer: Principles & Practice of Oncology. 11th edition. Philadelphia: Wolters Kluwer, 2019
- Imboden S, Nastic D, Ghaderi M, Rydberg F, Rau TT, Mueller MD, et al. (2019) Phenotype of POLE-mutated endometrial cancer. PLoS ONE 14(3): e0214318. https://doi.org/10.1371/journal.pone.0214318
- NCCN. NCCN Clinical Practice Guidelines in Oncology: Uterine Neoplasms. Nccn 2021.
- Murali R, Delair DF, Bean SM, Abu-Rustum NR, Soslow RA. Evolving Roles of Histologic Evaluation and Molecular/Genomic Profiling in the Management of Endometrial Cancer. J Natl Compr Canc Netw. 2018;16(2):201-209. doi:10.6004/jnccn.2017.7066
- Нечушкина В. М., Коломиец Л. А., Кравец О. А., Морхов К. Ю., Новикова Е. Г., Новикова О. В.
и соавт. Практические рекомендации по лекарственному лечению рака тела матки и сарком матки. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).14 - Talhouk A, McAlpine JN. New classification of endometrial cancers: the development and potential applications of genomic-based classification in research and clinical care. Gynecol Oncol Res Pract. 2016;3:14. Published 2016 Dec 13. doi:10.1186/s40661-016-0035-4
- Bell DW, Ellenson LH. Molecular Genetics of Endometrial Carcinoma. Annu Rev Pathol Mech Dis 2019;14:339–67. doi:10.1146/annurev-pathol-020117-043609.
