Рак предстательной железы
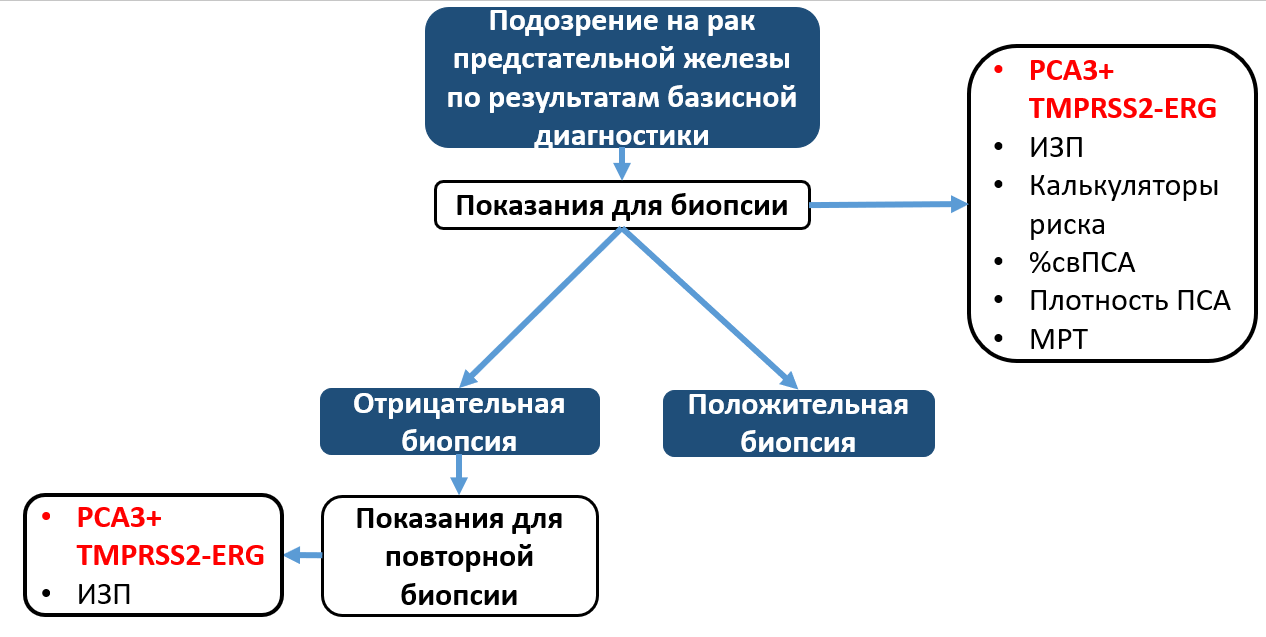
Рак предстательной железы является вторым по распространенности злокачественным новообразованием у мужчин: в 2018 году было диагностировано 1,3 миллиона новых случаев. В России в 2017 году РПЖ занял 3 место (8,1%) в структуре смертности от злокачественных новообразований. Использование ПСА в качестве лабораторного метода скрининга и ранней диагностики затруднено ввиду его низкой специфичности, что обуславливает большое количество ложноположительных результатов у пациентов с доброкачественной гиперплазией предстательной железы и хроническим простатитом. Часто применяемое пороговое значение ПСА >4 нг/мл в комбинации с данными пальцевого ректального исследования и трансректального УЗИ. Только 25% пациентов c повышением уровня ПСА имеют положительный результат биопсии. Таким образом, у большого числа пациентов повышенный уровень ПСА приводит к ненужным биопсиям, которые часто сопровождаются осложнениями. К тому же 15% пациентов с РПЖ имеют значение ПСА <4 нг/мл. Для увеличения специфичности ПСА были предложены его различные модификации и дериваты, такие как возрастные уровни ПСА, плотность ПСА, скорость прироста ПСА, процент свободного ПСА. Однако данные лабораторные тесты также не обладают достаточной точностью. Кроме того, большая часть случаев РПЖ представляет собой индолентное заболевание с крайне низким потенциалом прогрессирования и отсутствием влияния на качество жизни. Процент пациентов с низким риском прогрессирования составляет 50-60% новых диагностированных случаев. Таким образом, отсутствие маркеров с высокой диагностической точностью, а также гипердиагностика индолентных опухолей и, как следствие, их чрезмерное лечение являются очевидными проблемами ранней диагностики РПЖ.
Расширение знаний о молекулярной биологии РПЖ привело к появлению новых маркеров. Одним из наиболее значимых биологических материалов для их поиска служит моча, куда через протоки предстательной железы попадают опухолевые клетки, в том числе нуклеиновые кислоты. Так, наиболее специфичными в отношении рака простаты являются PCA3 и TMPRSS2-ERG. PCA3, ранее называемый DD3, является одним из наиболее известных опухоль-специфичных маркеров в моче, определение которого было одобрено FDA (управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) в 2012 у мужчин старше 50 лет с уровнем ПСА более 4 нг/мл, которые имеют одну и более биопсий с отрицательным результатом. Многочисленные исследования показали, что применение TMPRSS2-ERG позволяет улучшить точность диагностики РПЖ. Комбинация TMPRSS2-ERG и PCA3 также была предложена в качестве способа улучшения диагностики РПЖ. По результатам недавнего обзора было показано, что чувствительность данной комбинации для диагностики РПЖ составила 90%, а специфичность 80%.
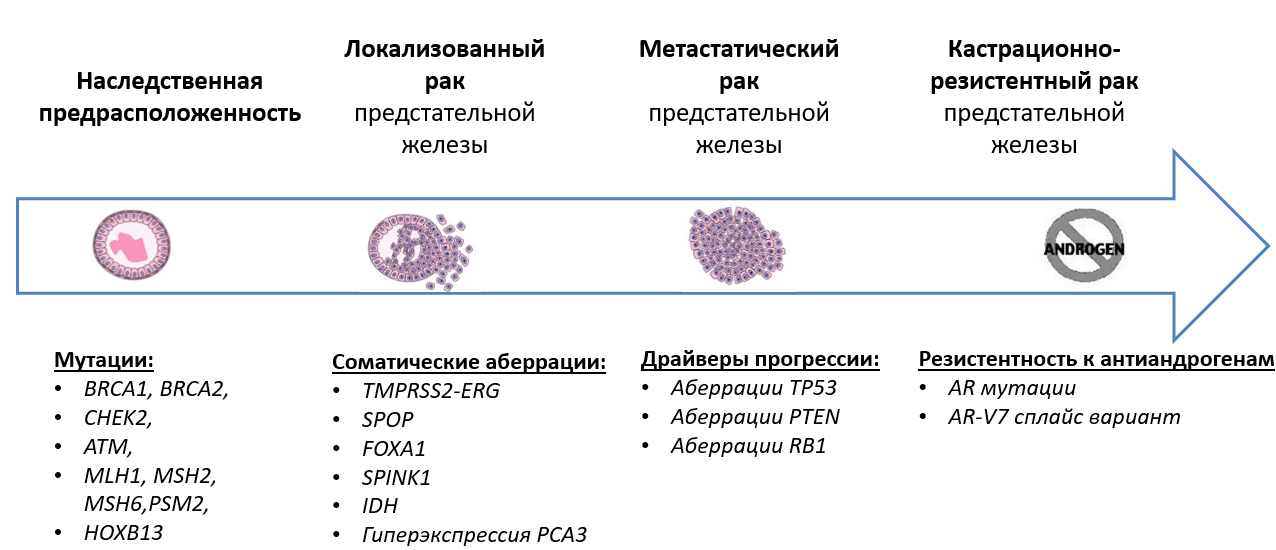
Фактически, РПЖ является крайне гетерогенным заболеванием, которое варьирует от клинически не значимых форм до крайне быстропрогрессирующего кастрационно-резистентного РПЖ. В ходе многоцентрового исследования ProtecT мужчины с клинически локализованным РПЖ были рандомизированы в группу активного мониторинга и группу хирургического лечения (радикальная простатэктомия) с последующей лучевой терапией. По результатам 10-летнего наблюдения не было показано различий в онкоспецифической смертности. Однако у мужчин, которым проводился активный мониторинг, был установлен повышенный риск клинического прогрессирования и появления метастатического заболевания (22,9 пациентов с возникшим метастатическим РПЖ на 1000 наблюдаемых человек в ходе 10 летнего контроля) по сравнению с хирургическим лечением и лучевой терапией (8 и 9 на 1000 человек в ходе 10-летнего наблюдения, соответственно). В группе, получавших хирургическое лечение либо лучевую терапию отмечалось наибольшее большое число побочных эффектов терапии. Это в целом соответствовало другим исследованиям лечения РПЖ. Определение факторов, связанных с прогрессированием РПЖ, может помочь определить риск для мужчин, имеющих более агрессивные формы заболевания, и помочь в определении тактики ведения пациентов. Обнаружение маркеров, характерных для более агрессивных форм рака, позволит также определять объемы хирургического вмешательства. С другой стороны, в отсутствии маркеров прогрессии у многих больных возможно проведение нерво-сберегающей радикальной простатэктомии, которая позволяет сохранить мочеполовую функцию.
Подходы в определении тактики лечения значительно варьируют в разных странах, и даже в разных медицинских учреждениях. Обычным основанием для стратегии активного мониторинга являются низкий уровень сывороточного ПСА- <10 нг/мл, а также результат гистологического исследования материала биопсии: индекс Глисона <7, количество столбиков ткани со злокачественным процессом, максимальный процент вовлеченности в процесс столбика ткани. Однако, даже в строгих протоколах по включению пациентов в программы активного наблюдения, приблизительно у 30% больных, отобранных по вышеперечисленным параметрам, в течение 1-2 лет отмечается прогрессия заболевания, что требует оперативного вмешательства. Те пациенты, у которых была отмечена более агрессивная опухоль в период наблюдения после поставленного диагноза, вероятно, были ошибочно классифицированы по группе риска из-за проблем со “слепым” взятием биопсии. А более прицельное взятие материала с использованием данных МРТ позволяет значительно улучшить стратификацию риска на основе патоморфологического исследования полученных образцов. Среди всех гистологических параметров исследования биопсийных материалов индекс Глисона является наиболее прогностически значимым. Новые подходы к гистологической оценке опухолей позволили значительно увеличить практическую ценность данного показателя, что нашло отражение в делении индекса Глисона на пять дискретных и высокопрогностических групп градаций дифференцировки. Однако, несмотря на эти обновления, большинство специалистов сходятся в том, что на сегодняшний день достигнут предел того, какая информация может быть получена при проведении исследования материала биопсии, и необходим поиск прогностических маркеров, определяемых в тканях, для идентификации потенциально агрессивных форм РПЖ.
Одним из новых и многообещающих прогностических биомаркеров на основе анализа ДНК является определение потери гетерозиготности классических генов-супрессоров опухолей, к которым относятся TP53, PTEN и RB1. Отмечаются что они становятся частой мишенью генных перестроек при первичном РПЖ. Инактивация данных генов приводит к аберрантной работе сигнальных путей PI3K/AKT, RAS/ RAF, а также нарушению клеточного цикла. Благодаря молекулярно-генетическому профилированию метастатических кастрационно-резистентных РПЖ было показано, что изменения генов TP53, PTEN и RB1 значительно чаще отмечаются при резистентном заболевании, что свидетельствует о том, что потеря гетерозиготности данных генов может играть ключевую роль в прогрессии опухоли. Также потеря RB1 является почти повсеместным явлением при РПЖ с нейроэндокринной дифференцировкой, которая представляет собой агрессивную андрогеннезависимую форму заболевания. Было показано, что в клетках-предшественниках и стволовых клетках простаты инактивация Pten/TP53 приводит к появлению нейроэндокринного клеток и опухоль-инициирующему фенотипу.
Доклинические исследования показывают, что сосуществование потери гетерозиготности генов TP53, RB1 и PTEN может приводить к появлению метастатического заболевания. На мышиных моделях было продемонстрировано, что инактивация Rb1 или Trp53 приводит к появлению простатической интраэпителиальной неоплазии (ПИН); однако двойная инактивация способствует нейроэндокринной дифференцировке с быстрым развитием метастазов, резистентности к антиандрогенам, трансдифференцировке путем повышения экспрессии Sox2. Так, Sox2 является ре-программируемым фактором, высокая активность, которого определяется в клеточных линиях из простаты, резистентных к энзалутамиду, нестероидному антиандрогенному препарату второго поколения. Инактивация у мышей генов Trp53 и Pten по отдельности не приводит к быстрой прогрессии опухолей простаты. Однако комбинированная инактивация приводит к быстрому появлению инвазивного и метастатического заболевания. В свою очередь, потеря Rb1 на фоне дефицита Pten, по-видимому, способствует появлению метастатического потенциала.
Помимо классических генов-супрессоров опухолей в нескольких исследованиях было показано, что потеря генов BRCA1/2 также ассоциирована с наличием агрессивного фенотипа. В свою очередь, совместная инактивация Brca2 и Trp53 приводило к появлению злокачественного новообразования с метастатическим потенциалом.
Немаловажной является проблема резистентности к андроген-депривационной терапии (АДТ) у пациентов с местнораспространенным и метастатическим РПЖ. Основным достижением последнего десятилетия в изучении данного вопроса является выявление важнейшего механизма резистентности к проводимой терапии, который заключается во внутриопухолевым синтезе андрогенов. В ходе одного исследования было показано, что наследственного аллельный вариант HSD3B1 (1245C) встречается в 15-35% случаев в популяции. При РПЖ данный аллельный вариант приводит к накоплению белка 3-бета-гидроксистероиддегидрогеназа 1 типа и, как следствие, увеличению синтеза внутриопухолевых андрогенов из внегонадных предшественников, что способствует резистентности к андрогенной депривации. Данный аллельный вариант может быть приобретенным вследствие появления мутации. В ходе одного исследования было показано, что наличие HSD3B1 (1245C) является предиктором продолжительного ответа на терапию CYP17A1 ингибитором кетоконазолом, рутинное применение которого в настоящее ограниченно у пациентов с кастрационно-резистентным РПЖ. Также предстоит выяснить, является ли высокий внутриопухолевый синтез андрогенов, обусловленный данным вариантом, драйвером быстрой прогрессии метастатического заболевания и, следовательно, возможностью раннего применения химиотерапии препаратами из группы таксанов до появления биохимического рецидива.
Рак предстательной железа PCA3
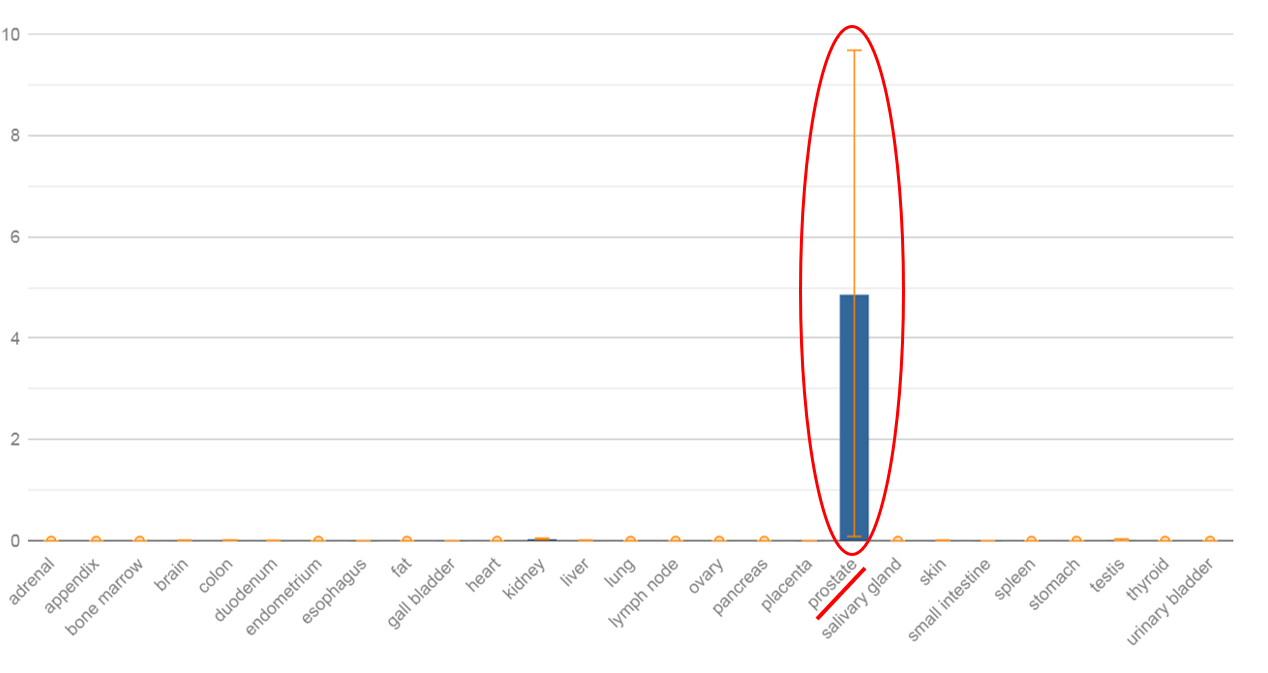
В 1999 году группой исследователей было показано, что РСА3 специфически экспрессируется в тканях РПЖ в 10-100 раз выше в сравнении с окружающей здоровой, немалигнизированной, тканью предстательной железы у 53 из 56 пациентов, которым была проведена РПЭ. PCA3 представляет собой некодирующую РНК, расположенную на хромосоме 9q21-22, и содержит высокую плотность стоп-кодонов, биологическая функция которых неизвестна. Недавнее исследование показало, что PCA3 модулирует транскрипционную активность генов-мишеней андрогеновых рецепторов, которые могут играть роль в контроле клеточного выживания РПЖ.
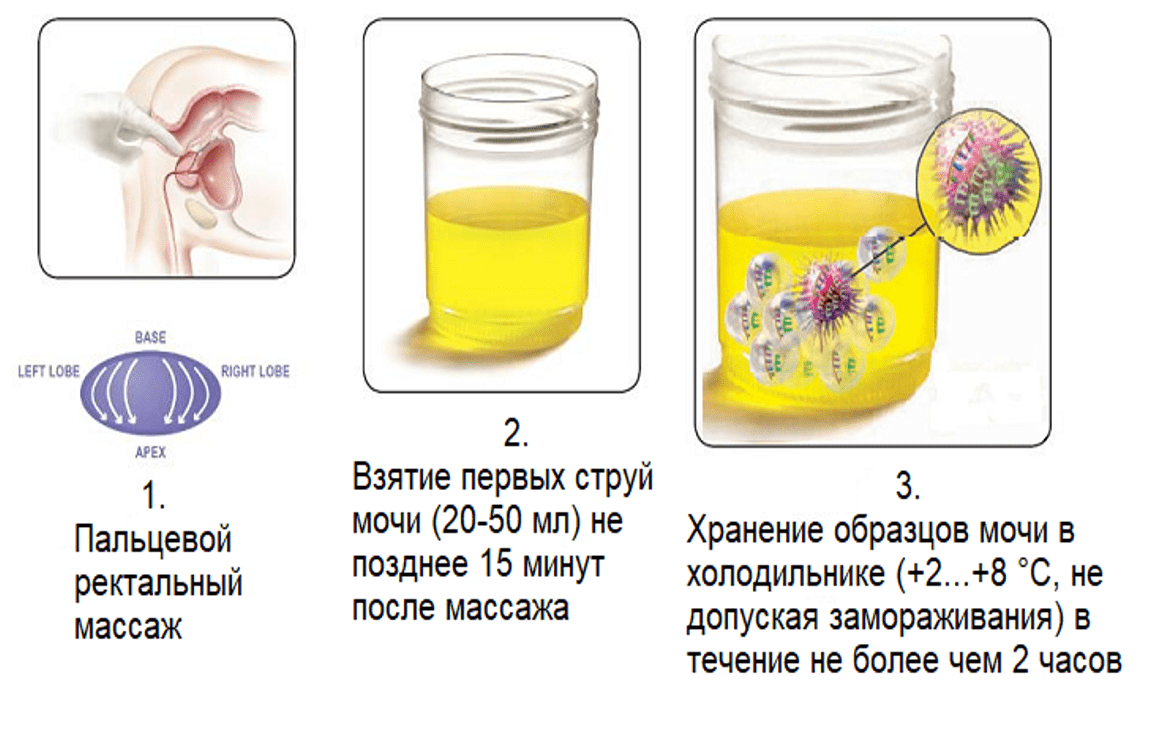
С момента открытия PCA3 группой ученых под руководством Bussemakers, были разработаны различные методы по внедрению данного маркера в клиническую практику в качестве ранней диагностики РПЖ. Наиболее успешным из них является тест Progensa TM PCA3. Данный тест был одобрен FDA. Для оценки потенциальной полезности PCA3 в качестве диагностического маркера РПЖ был разработан тест на основе использования полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР). Экспрессия PCA3 определяется в осадке мочи после проведенного пальцевого ректального массажа, при котором происходит слущивание клеток предстательной железы в уретру. Было показано, что гиперэкспрессия PCA3 в 66 раз выше в ткани РПЖ, чем в здоровой ткани предстательной железы. Было отмечено, что ткань предстательной железы, содержащая менее 10% злокачественных клеток, имеет в среднем 11-кратное увеличение экспрессии PCA3, что позволяет обнаруживать с помощью ОТ-ПЦР даже малое число опухолевых клеток на фоне нормальных клеток в образцах мочи.
В исследовании Merola и др. была показана роль PCA3 в обнаружении РПЖ, преимущественно имеющего агрессивный патоморфологический фенотип, у 407 пациентов высокого риска. Использование PCA3 показало выше диагностическую значимость в сравнении с такими тестами, как оПСА и %сПСА, что способствовало более точному выбору пациентов с высоким риском, которым проведение биопсии предстательной железы может оказаться наиболее эффективным для верификации РПЖ.
Диагностическая значимость РСА3. В первоначальном исследовании Fradet и др. была показано, что чувствительность маркера составляет 74%, специфичность — 91%, прогностическая ценность положительных результатов (PPV)- 75% в качестве диагностики РПЖ у пациентов со значением ПСА менее 4 нг/мл. В свою очередь, PPV при использовании оПСА составил всего 38%. После этих многообещающих результатов были предприняты попытки в установлении пороговых значений для PCA3. В проспективном многоцентровом исследовании, включавшим 463 мужчин с предшествующей отрицательным результатом биопсии предстательной железы, Haese и др. обнаружили высокую вероятность положительных результатов гистологического исследования при повторной биопсии при уровне PCA3 ≥35 (39%) по сравнению с пациентами со значением PCA3 <35 (22%, р <0,0001). PCA3 является независимым предиктором обнаружения РПЖ при повторной биопсии (р <0,007) и имеет более высокую диагностическую точность по сравнению с %сПСА.
Выбор порогового значения PCA3 остается противоречивым, хотя уровень >35 является наиболее часто используемым. В практических рекомендациях NCCN также предложено значение >35 в качестве порогового для выявления РПЖ. Однако FDA рекомендовано другое пороговое значение: так уровень экспрессии PCA3 менее 25 ассоциирован со сниженной вероятностью обнаружения злокачественного процесса в образцах биопсии. Так, Roobol et al. показали, что при использовании порогового значения PCA3 >35 можно избежать 51.7% ненужных биопсий. Однако авторы подчеркивают, что при таком показателе могут быть пропущены до 32% случаев РПЖ, в частности 26,3% случаев клинически значимого РПЖ. Кроме того, согласно данным Bradley et al., число пропущенных биопсий можно снизить с 39% до 6% путем снижения порогового значения до 10, но при этом будет значительно снижена специфичность теста.
В ходе проспективного многоцентрового клинического исследования, в которое были включены 466 мужчин с минимум одним отрицательным результатом биопсии, было продемонстрировано, что PCA3 позволяет определять необходимость проведения повторной биопсии. Так, PCA3 при пороговом значении 25 имеет чувствительность 78%, специфичность 57%, а прогностическая ценность отрицательного и положительного результата составляет 90% и 34%, соответственно. Другое многоцентровое исследование, включавшее 859 мужчин, которым была выполнена диагностическая биопсия, показало, что прогностическая ценность положительного результата при выполнении первичной биопсии составила 80%, а прогностическая ценность отрицательного результата при повторной биопсии- 88%. Таким образом, использование показателя PCA3 для решения вопроса о проведении повторной биопсии позволяет уменьшить количество выполняемых биопсий наполовину, и при низком уровне PCA3 будут пропущены только 3% пациентов с клинически значимым РПЖ (индекс Глисона >7).
Прогностическая ценность PCA3. Степень дифференцировки РПЖ тесно связана с прогнозом, биологическим фенотипом, подходом к лечению и исходом заболевания. Система оценки дифференцировки по Глисону используется для оценки прогноза РПЖ по результатам оценки микроскопического строения компонентов опухоли. Многочисленные исследования указывают на корреляцию между PCA3 и индексом Глисона. Ploussard и его коллегами была проведена оценка 106 пациентов с РПЖ низкого риска перед проведением РПЭ и показана корреляция между значением PCA3 и клинически значимым РПЖ, при пороговом значении маркера 25. Однако, при многопараметическом анализе PCA3 при пороговом значении 35 не являлся независимым фактором наличия индекса Глисона более 7. Таким образом, в настоящее время клиническое значение PCA3 как прогностического маркера агрессивности опухоли неоднозначна.
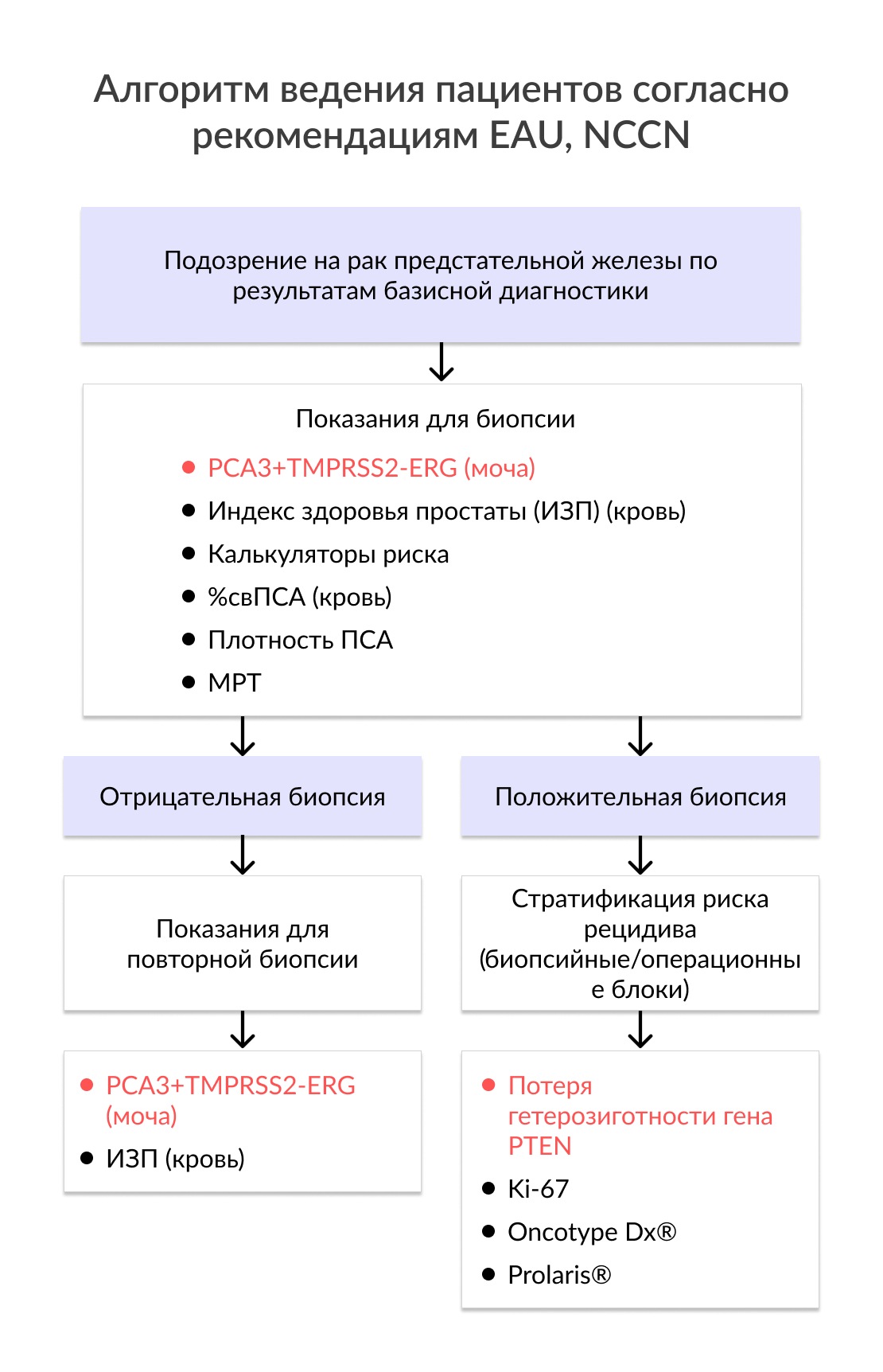
Практические рекомендации. Исследование уровня PCA3 является наиболее полезным для определения необходимости повторной биопсии у пациентов с отрицательными результатами гистологического исследования первичных биоптатов (EAU, 2019). Использование PCA3 позволяет уменьшить число повторных биопсий наполовину (NCCN, 2020). Применение PCA3 также позволяет определить необходимость проведения первичной биопсии у мужчин с отсутствием патологических изменений предстательной железы при пальцевом ректальном исследовании (ПРИ) и с уровнем ПСА в пределах от 2 до 10 нг/мл (EAU, 2019).
Несмотря на существующие некоторые ограничения в применении PCA3, он все еще является ключевым методом в диагностике РПЖ, особенно диагностическая точность PCA3 увеличивается в комбинации с другими маркерами, такими как химерный ген TMPRSS2-ERG, который является еще одним биомаркером РПЖ.
Транслокация TMPRSS2-ERG: молекулярная биология, эпидемиология
Предполагается, что геномные перестройки являются основным механизмом развития туморогенеза предстательной железы. Транслокация TMPRSS2-ERG является специфичным химерным геном для РПЖ, который приводит к аберрантной экспрессии фактора транскрипции ERG. TMPRSS2-ERG может являться опухоль-инициирующим событием, так как он может экспрессироваться как на уровне РНК, так и на уровне белка в стволовых клетках РПЖ. Недавние исследования показали, что химерный ген может играть важную роль в активизации сигнального пути трансформирующего фактора роста бета (TGF-β). Стоит отметить, что сигнальный путь TGF-β участвует в клеточной пролиферации, дифференцировке, миграции, адгезии и апоптозе. TMPRSS2-ERG является наиболее частой аберрацией в РПЖ и детектируется в 50% случаев РПЖ, преимущественно в западных странах. Стоит отметить, что данная транслокация не обнаружена при доброкачественной гиперплазии предстательной железы (ДГПЖ). Однако распространенность химерного гена TMPRSS2-ERG у мужчин с РПЖ из стран Азии несколько ниже, чем в Европе. Так, частота встречаемости данной транслокации в Японии составляет 20-28%, в Корее- 21% и 11% в Китае, что указывает на расовые или этнические различия в эпидемиологии перестройки TMPRSS2-ERG.
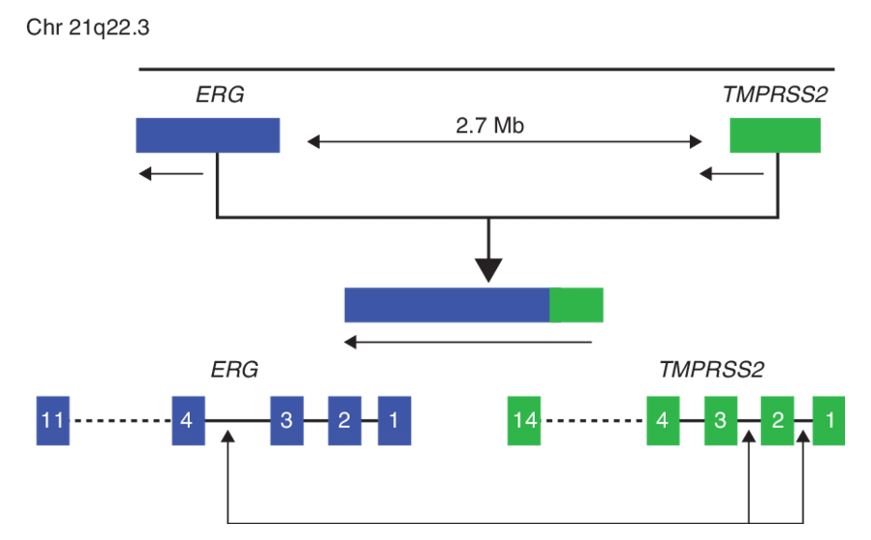
TMPRSS2-ERG: диагностическая значимость. мРНК продукт химерного гена TMPRSS2-ERG был впервые обнаружен в моче с помощью ОТ-ПЦР. Показатель TMPRSS2-ERG в моче статистически значимо коррелировал с экспрессией ERG в ткани РПЖ. Определение данной транслокации в моче для диагностики РПЖ показало чувствительность 37%, а специфичность 93%. Такая специфичность теста обусловлена тем, что TMPRSS2-ERG является ранним геномным событием, которое обнаруживается как в локализованном РПЖ, так и в простатической эпителиальной неоплазии высокой степени (HGPIN) (до 15% случаев), но не определяется в здоровой ткани. Park K. и его коллеги продемонстрировали, что у пациентов, имеющих HGPIN по результатам гистологического исследования, с наличием TMPRSS2-ERG статистически значимо выше вероятность обнаружения РПЖ в ходе последующего наблюдения.
Использование ПСА в комбинации с TMPRSS2-ERG либо PCA3 позволяет снизить число повторных биопсий более чем наполовину. При этом, не было показано негативных последствий с точки зрения 10-летней общей выживаемости либо 15-летней раково-специфической выживаемости. Следовательно, использование данного подхода позволит избежать большого числа ненужных инвазивных процедур. Комбинация двух биомаркеров, таких как TMPRSS2-ERG и PCA3 в моче, может улучшить диагностику РПЖ. Применение интегративного подхода позволило увеличить чувствительность до 88%, а диагностическую точность до 84%, что значительно превышает данный показатель у ПСА. В ходе проспективного исследования 516 мужчин использование комбинации PCA3 и TMPRSS2‐ERG для обнаружения агрессивных форм РПЖ показало чувствительность 95%, а специфичность- 39%. При этом, применение двух маркеров позволило избежать 42% ненужных биопсий.
Также добавление PCA3 и TMPRSS2‐ERG в калькуляторы риска позволяет значительно повысить диагностическую точность. Так, добавление данных маркеров в калькулятор риска ERSPC (European Randomized Study of Screening for Prostate Cancer) увеличило показатель AUC с 0.799 до 0.842. В ходе проспективного исследования было показано, что включение PCA3 и TMPRSS2‐ERG в калькулятор риска PCPT (Prostate Cancer Prevention Trial) позволило увеличить AUC с 0.639 до 0.762, в свою очередь, AUC для обнаружения РПЖ высокого риска составил 0.779.
TMPRSS2‐ERG: прогностическая значимость. Прогностическая роль данного маркера все еще остается неопределенной. Rajput и др. обнаружили более частую встречаемость TMPRSS2-ERG в группе промежуточного и высокого риска РПЖ. Была показана ассоциация наличия транскрипта данного химерного гена с высоким уровнем ПСА, патоморфологической стадией и индексом Глисона. Однако, в других исследованиях TMPRSS2-ERG не коррелировал с индексом Глисона в образцах опухоли, полученных в ходе РПЭ, и его прогностическая ценность нуждается в дальнейшей оценке. Аналогичные результаты были получены в ходе когортного анализа 1180 мужчин, которым проведена РПЭ: транслокация ассоциирована со стадией первичной опухоли, но TMPRSS2-ERG не был показан предиктором раннего биохимического рецидива и смертности. Однако более короткое время до рецидива после проведенной РПЭ наблюдалось у пациентов с высокой экспрессией TMPRSS2-ERG в ткани РПЖ и высоким предоперационным уровнем ПСА. Комбинация высокой экспрессии TMPRSS2-ERG в опухолевой ткани и высокого предоперационного значения ПСА была предложена в качестве многообещающего биомаркера для оценки риска рецидива после РПЭ.
Практические рекомендации. Использование TMPRSS2-ERG в сочетании с определением уровня экспрессии PCA3 в моче и уровня простатического специфического антигена (ПСА) в крови позволяет значительно увеличить точность диагностики РПЖ (NCCN, 2020). Использование комбинации данных маркеров позволяет определить необходимость проведения как первичной, так и повторной биопсии у мужчин с отсутствием патологических изменений предстательной железы при пальцевом ректальном исследовании (ПРИ) и с уровнем ПСА в пределах от 2 до 10 нг/мл (EAU, 2019; NCCN, 2020).
Потеря гетерозиготности генов PTEN, RB1, TP53 при раке предстательной железы
С повсеместным применением ПСА тестирования появилась проблема гипердиагностики, что привело к чрезмерному лечению, которое негативно сказывается на качестве жизни пациента. Метод активного наблюдения развился в качестве альтернативы радикальному лечению больных с потенциально индолентными опухолями с целью уменьшения осложнений чрезмерного лечения. Согласно существующим рекомендациям потенциальными кандидатами для данного метода ведения являются пациенты групп очень низкого, низкого и благоприятного промежуточного риска с ожидаемой продолжительностью жизни ≥10 лет. При этом лечение откладывают до тех пор, пока не будут наблюдаться признаки прогрессии заболевания: появление более агрессивной опухоли (группа градации 4 или 5), а также наличие большего количества положительных столбиков по результатам повторной биопсии. Однако, при использовании вышеперечисленных критериев включения в протоколы активного наблюдения у приблизительно трети пациентов в течение 1-2 лет наблюдается ре-классификация группы риска. Одним из путей улучшения отбора пациентов для метода активного наблюдения является уточнение молекулярно-генетического профиля опухоли каждого пациента. В последние годы появились несколько коммерческих наборов на основе анализа экспрессии мРНК генов для определения агрессивности опухолей. Тест-системы были валидированы в когортах с низким риском РПЖ, однако данные проспективных наблюдений в большинстве случаев отсутствуют. Одним из недостатков анализа РНК является также трудности на преаналитическом этапе: условия и время хранения материала.
Среди прогностических ДНК-маркеров потеря гетерозиготности гена PTEN является наиболее перспективным подходом. Инактивация гена PTEN является одной из частых находок при РПЖ. Данная аберрация ассоциирована с неблагоприятными клинико-морфологическими особенностями новообразования, такими как наличие низкодифференцированной опухоли, местнораспространенного процесса, более коротким временем до появления биохимического рецидива после проведенной радикальной простатэктомии (РПЭ), наличие метастазов, высоким уровнем онкоспецифической смертности и андрогеннезависимой прогрессии заболевания. В ходе проведенного метаанализа семи ранее опубликованных исследований было показано, что делеция PTEN статистически значимо коррелирует с высоким индексом Глисона и высокой вероятностью обнаружения распространения опухоли за капсулу предстательной железы у пациентов с локализованным РПЖ, которым была выполнена РПЭ. По результатам ряда крупных исследований была продемонстрирована значимая ассоциация потери гетерозиготности PTEN и наличия высокого риска появления биохимического рецидива после проведенной РПЭ. Выявление изменений гена PTEN оказалось независимым предиктором онкоспецифической смертности у пациентов, получавших консервативное или хирургическое лечение.
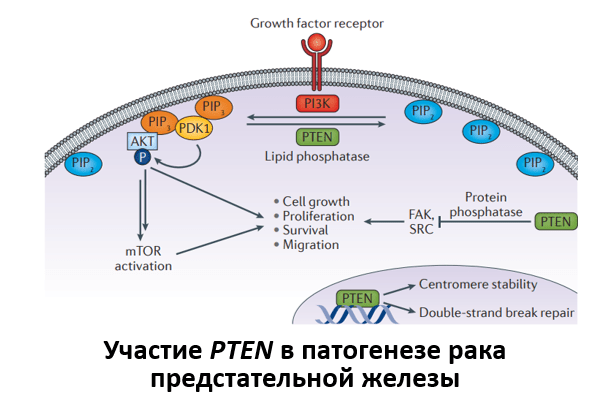
Исходя из взаимосвязи потери гетрозиготности гена PTEN с высоким индексом Глисона, определение данной аберрации может быть полезным биомаркером при локализованном РПЖ. В этом контексте определение статуса PTEN может потенциально улучшить существующие протоколы стратификации риска, когда оценка индекса Глисона является неполной, особенно в группах с низким и промежуточным риском. Инактивация PTEN, как правило, встречается примерно в два раза чаще при РПЖ c индексом Глисона 7 (группа градации 2-3) по сравнению с опухолью с индексом Глисона 6 (группа градации 1) в образцах, полученных при проведении РПЭ. Обнаружение потери гетерозиготности гена PTEN в образцах биопсии с индексом Глисона 6 является предиктором выявления прогрессии до Глисона 7 и выше в материале, полученном в ходе РПЭ. В биопсийном материале с градацией дифференцировки 2 выявление инактивации гена PTEN статистически значимо ассоциировано с двукратным увеличением риска обнаружения распространения опухоли за пределы капсулы предстательной железы в опухолевых образцах. В ходе первого исследования оценки возможности применения данного маркера в когорте пациентов с РПЖ c индексом Глисона 6, у которых был использован метод активного наблюдения, было показано, что инактивация PTEN связана с повышенным риском прогрессии заболевания, проведения противоопухолевого лечения, а также обнаружением неблагоприятных патоморфологических признаков в материале РПЖ. Наконец, в нескольких исследованиях, посвященных изучению статуса PTEN в биопсийном материале, определялись конечные точки, такие как безметастатическая выживаемость и онкоспецифическая смертность. По результатам одного исследования было показано, что потеря гетерозиготности гена PTEN в образце биопсии предсказывала повышенный риск появления метастазов, кастрационно-резистентного РПЖ и увеличение онкоспецифической смертности у пациентов, получавших хирургическое лечение. Можно обобщить, что имеющиеся данные подтверждают использование делеции PTEN в качестве раннего маркера агрессивных форм РПЭ в образцах биопсии с градацией дифференцировки 1. В этих случаях определение статуса PTEN позволит дополнить прогностическую информацию шкалы Глисона, а также персонализировать терапию пациентов. Так, наличие данного маркера будет служить противопоказанием для включения пациентов в протоколы активного наблюдения.
Белок RB1 является ключевым звеном контроля клеточного цикла. Его каноничная роль как негативного регулятора транскрипционного фактора E2F проявляется в его гипофосфорилированном состоянии. При стимуляции митогенными сигналами циклины D-типа и циклин-зависимые киназы CDK4/6 приводят к фосфорилированию RB, что способствует высвобождению белка E2F и, как следствие, переходу из G1 в S фазу и прохождению клеточного цикла. Потеря гетерозиготности гена RB1 является наиболее частым нарушением клеточного цикла, наблюдаемым в кастрационно-резистентном РПЖ в приблизительно 20% случаев. Важно отметить, что сниженная экспрессия RB1 приводит к увеличению экспрессии AR-регулируемых генов путем E2F1-зависимого механизма. Гиперактивация сигнального пути AR- рецептора в опухоли с потерей RB1 может влиять на эффективность проводимой антиандрогенной терапией абиратероном и энзалутамидом. Кроме того, in vitro было показано, что РПЖ с инактивацией RB1 обладают высокой чувствительностью к таксанам. Эти данные позволяют предположить, что определение статуса RB1 может играть роль предиктивного биомаркера при проведении как гормональной, так и цитотоксической терапии.
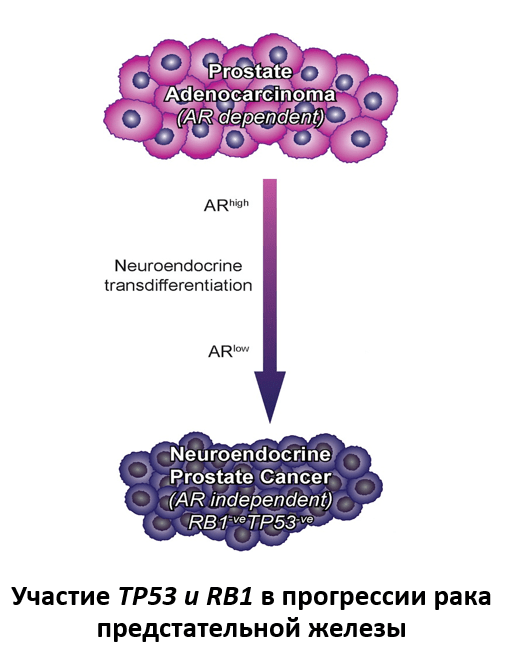
Наконец, небольшое подмножество РПЖ имеет нейроэндокринную дифференцировку, которая представляет собой низкодифференцированную опухоль, эквивалентную мелкоклеточной нейроэндокринной карциноме. Данная карцинома возникает после проводимой блокады сигнального пути AR- рецептора и обычно относится к клинически агрессивным злокачественным новообразованиям, характеризующимися незначительной экспрессией AR и AR-регулируемых генов. Важно отметить, что делеции RB1 значительно более распространены в кастрационно-резистентном РПЖ с нейроэндокринной дифференцировкой (70%), чем при кастрационно-резистентной аденокарциноме (32%). В свою очередь, одновременная потеря RB1 и TP53 происходит в более чем 50% случаев кастрационно-резистентной РПЖ с нейроэндокринной дифференцировкой и только в 13,7% случаях кастрационно-резистентной аденокарциномы. Кроме того, в 90% мелкоклеточных нейроэндокринных карцином обнаруживается потеря экспрессии белка RB1. Эти данные позволяют предположить, что группа кастрационно-резистентнго РПЖ с потерей RB1 представляет собой отдельный, AR-независимый фенотип. Изучение новых терапевтических стратегий для данных опухолей продолжается, и выявление повышенной экспрессии AURKA и NMYC в данной группе РПЖ указывает на потенциально интересный подход с использованием соединений, направленных на AURKA.
Аберрации в гене TP53 отмечаются в половине случаев всех злокачественных новообразований, что позволяет говорить о том, что данный ген является наиболее подверженным альтерациям. Однако, по сравнению с другими карциномами, мутации в гене TP53 относительно редки при РПЖ, причем распространенность составляет около 7% по данным атласа ракового генома (TCGA). Небольшая распространенность аберраций в гене TP53 при РПЖ может быть отражением в целом более низкой мутационной нагрузки, наблюдаемой при данном новообразовании, по сравнению с другими карциномами. Однако, в ходе недавних исследований кастрационно-резистентного РПЖ было показано, что распространенность аберраций в TP53 значительно выше: мутации в гене обнаруживаются в 40% случаев, а гомозиготные делеции или перестройки, затрагивающие данный ген- в 10% случаев. Такое колоссальное различие во встречаемости альтераций TP53 в кастрационно-резистентном РПЖ по сравнению с локализованной опухолью сопоставимо только с появлением аберраций в гене AR при проведении андрогенной депривации. Учитывая, что альтерации TP53 часто являются ранним клональным событием прогрессии опухоли до появления метастатического заболевания, первичные опухоли с аберрантным TP53 с большой вероятностью имеют необычно агрессивное клиническое течение, которое потенциально может быть предсказано на ранней стадии.
| Молекулярное тестирование | Препараты, одобренные на территории РФ, а также используемые в рамках клинических исследований (*) |
| Микросателлитная нестабильность | Анти-PD-1 антитела: пембролизумаб* |
| BRCA1/2 | Ингибитор PARP: олапариб*, рукапариб* |
Зеленый — чувствительность к терапии, Красный — резистентность к терапии.
| Ген | Краткая информация |
| Индекс PCA3 | • PCA3 представляет собой опухоль-специфический маркер и обнаруживается в осадке мочи, полученном в ходе трехкратного массажа предстательной железы. • Также возможно определение PCA3 без проведения массажа, однако данный подход снижает чувствительность метода. • Исследование иднекса PCA3 является наиболее полезным для определения необходимости повторной биопсии у пациентов с отрицательными результатами гистологического исследования первичных биоптатов (EAU, 2019). • Использование PCA3 позволяет уменьшить число повторных биопсий наполовину (NCCN, 2020). • Применение индекса PCA3 также позволяет определить необходимость проведения первичной биопсии у мужчин с отсутствием патологических изменений предстательной железы при пальцевом ректальном исследовании (ПРИ) и с уровнем ПСА в пределах от 2 до 10 нг/мл (EAU, 2019). Показания: Рекомендовано всем пациентам с подозрением на рак предстательной железы для определения показаний к проведению как первичной, так и повторной биопсии у мужчин с отсутствием патологических изменений предстательной железы при пальцевом ректальном исследовании и с ПСА в пределах от 2 до 10 нг/мл. |
| TMPRSS2-ERG | • Выявление перестройки TMPRSS2-ERG в моче у пациента увеличивает клиническую вероятность обнаружения рака предстательной железы (РПЖ). • Перестройка TMPRSS2-ERG детектируются в половине всех случаев РПЖ (EAU, 2019). • Использование данного маркера в сочетании с определением уровня экспрессии PCA3 в моче позволяет значительно увеличить точность диагностики РПЖ (NCCN, 2019). • Использование комбинации вышеперечисленных маркеров позволяет определить необходимость проведения как первичной, так и повторной биопсии у мужчин с отсутствием патологических изменений предстательной железы при пальцевом ректальном исследовании (ПРИ) и с уровнем ПСА в пределах от 2 до 10 нг/мл (EAU, 2018). Показания: Индекс PCA3 в комбинации с TMPRSS2-ERG рекомендован всем пациентам с подозрением на рак предстательной железы для определения показаний к проведению как первичной, так и повторной биопсии у мужчин с отсутствием патологических изменений предстательной железы при пальцевом ректальном исследовании и с ПСА в пределах от 2 до 10 нг/мл. |
| Потеря гетерозиготности гена PTEN | • Потеря гетерозиготности гена PTEN встречается в 15-22% случаев РПЖ. • Показано, что данный маркер может быть использован в качестве раннего маркера агрессивных форм РПЖ в образцах биопсии с группой градации 1. • Данная аберрация ассоциирована с неблагоприятными клинико-морфологическими особенностями новообразования, такими как наличие низкодифференцированной опухоли, местнораспространенного процесса, более коротким временем до появления биохимического рецидива после проведенной радикальной простатэктомии, высоким уровнем онкоспецифической смертности и андрогеннезависимой прогрессией заболевания. Показания: Рекомендовано пациентам с локализованным и местнораспространенным РПЖ для стратификации риска рецидива с целью персонализации тактики ведения пациентов (NCCN, 2020). |
| Микросателлитная нестабильность (MSI) | • Наличие MSI ассоциировано с ответом на терапию ингибиторами контрольных точек иммунитета. Показания: Рекомендовано пациентам с метастатическим РМЖ для определения показаний к проведению иммунотерапии (NCCN, 2020). |
Список литературы
- Jamaspishvili, T., Berman, D., Ross, A. et al. Clinical implications of PTEN loss in prostate cancer. Nat Rev Urol 15, 222–234 (2018)
- Hamid AA, Gray KP, Shaw G, et al. Compound Genomic Alterations of TP53, PTEN, and RB1 Tumor Suppressors in Localized and Metastatic Prostate Cancer. Eur Urol. 2019;76(1):89-97. doi:10.1016/j.eururo.2018.11.045
- Yang Z, Yu L, Wang Z. PCA3 and TMPRSS2-ERG gene fusions as diagnostic biomarkers for prostate cancer. Chinese J Cancer Res 2016. doi:10.3978/j.issn.1000-9604.2016.01.05.
- Fujita K, Nonomura N. Urinary biomarkers of prostate cancer. Int J Urol 2018. doi:10.1111/iju.13734.
- Mateo J, Carreira S, Sandhu S, Miranda S, Mossop H, Perez-Lopez R, et al. DNA-Repair Defects and Olaparib in Metastatic Prostate Cancer. N Engl J Med 2015;373:1697–708. doi:10.1056/NEJMoa1506859.
- Abida W, Cyrta J, Heller G, Prandi D, Armenia J, Coleman I, et al. Genomic correlates of clinical outcome in advanced prostate cancer. Proc Natl Acad Sci 2019;116:11428 LP – 11436. doi:10.1073/pnas.1902651116.
- Espiritu SMG, Liu LY, Rubanova Y, et al. The Evolutionary Landscape of Localized Prostate Cancers Drives Clinical Aggression. Cell. 2018;173(4):1003-1013.e15. doi:10.1016/j.cell.2018.03.029
