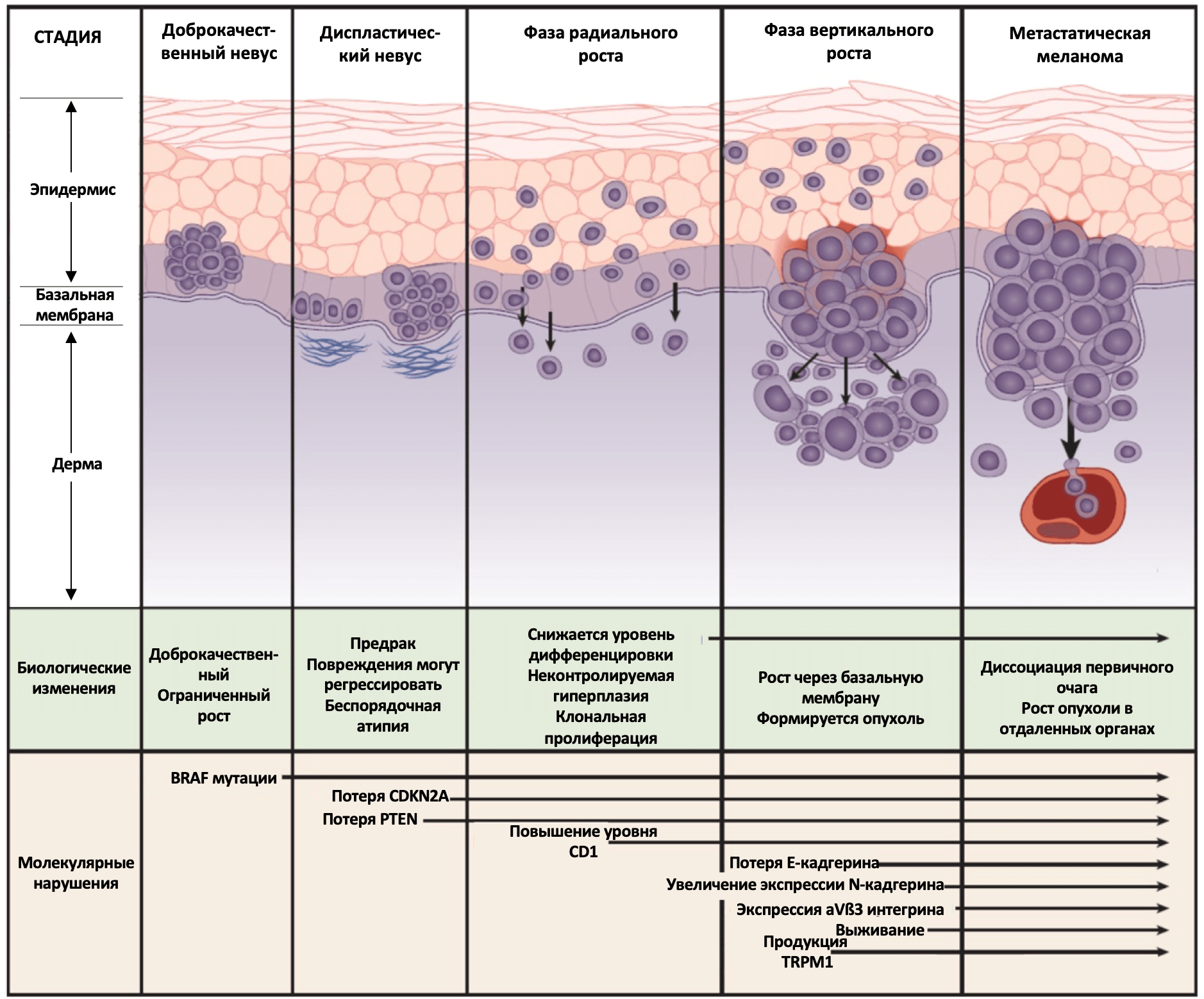
Меланома кожи
Меланома кожи является одной из наиболее распространенных злокачественных новообразований. Хотя в большинстве случаев у пациентов с локализованным заболеванием лечение ограничивается радикальным иссечением первичной опухоли, у некоторых пациентов развивается диссеминированное заболевание, у которых ключевое место в лечении занимает системная терапия. Понимание молекулярной биологии меланомы привело к введению новых методов системной терапии, таких как иммунотерапия и таргетная терапия, что способствовала снижению показателей смертности при диссеминированном заболевании. Несмотря на успехи в терапии в 2017 году диагностированы 87110 случаев меланомы, из которых 9730 привели к летальному исходу. Стоит отметить, что ежегодная заболеваемость и смертность от меланомы продолжает расти. В течение последних 25 лет темпы прироста ежегодной заболеваемости меланомой составляют почти 3% в год.
Меланома кожи развивается из меланоцитов, клеток, вырабатывающих пигмент. Множество исследований подтвердили связь между рисками возникновения меланомы кожи и воздействием ультрафиолетового (УФ) излучения. За последние два десятилетия знания о молекулярных механизмах и гетерогенности этого заболевания сильно расширились. В частности, с помощью расширенного секвенирования следующего поколения (Next-generation sequencing (NGS)) показано, что меланома обладает одним из самых высоких уровней соматических мутаций среди всех солидных опухолей. Преобладающими типом мутаций являются C/T или G/A замены, которые напрямую ассоциированы с УФ-индуцируемым повреждением ДНК. Таким образом подтверждается важная роль влияния окружающей среды на молекулярные механизмы развития данного заболевания. Спектр соматических аберраций также часто затрагивает гены, кодирующие молекулы сигнальных путей, что, вероятно, обуславливает патогенез меланомы кожи.
В 2015 году были опубликованы начальные результаты исследований Атласа Ракового Генома (The Cancer Genome Atlas (TCGA)) по меланоме кожи. Работа включала мультиплатформенный анализ 333 образцов меланомы кожи. Для TCGA это было первое исследование, основанное на изучении в основном метастатических опухолей, что было обусловлено очень маленьким размером большинства первичных очагов. Таким образом, когорта TCGA включала 266 метастатических (210 локальных и 35 отдаленных) и 67 первичных новообразований. Молекулярное тестирование включало полноэкзомное секвенирование, анализ копий ДНК, сиквенс матричных РНК (мРНК) и микроРНК, анализ метилирования ДНК, а также протеомный анализ с помощью белковых чипов с обращенной фазой (proteomic analysis by reverse phase protein arrays (RRPA)). Часть образцов были исследованы также с помощью полногеномного секвенирования. Полученные результаты схожи с предыдущими работами и демонстрируют высокую частоту распространения УФ-ассоциированных соматических мутаций при меланоме. С помощью полноэкзомного секвенирования было также подтверждено, что подавляющее большинство генетических мутаций при данном заболевании были обнаружены в генах сигнального пути MAPK (mitogen activated protein kinase). Описанные TCGA мутационные характеристики меланомы кожи чаще всего включали мутации трех генов этого сигнального пути: BRAF, RAS и NF1. Существует информация и о мутациях молекул других сигнальных путей. Вместе эти исследования обеспечивают понимание базовых принципов молекулярных механизмов патогенеза меланомы кожи (Рисунок 1).
Сигнальный путь МАРК
Cигнальный путь MAPK представляет собой каскад молекул, который активируется множеством клеточных сигналов. В свою очередь, каскад ведет к активации внеклеточных киназ (ERK1/ERK2), которые влияют на транскрипцию многих генов, ответственных за пролиферацию, жизнеспособность и другие ключевые процессы клеток, а также путем серин-треонин фосфорилирования оказывают воздействие на множество белков. Примерами факторов транскрипции, действующих в меланоцитах и регулируемых ERK-сигнальным путем, являются микрофтальмия-ассоциированные транскрипционные факторы (MITF), варианты ETS транскрипционных факторов, а также гены FOS, JUN и другие.
Генетические исследования показали широкую распространенность активирующих мутаций MAPK-сигнального пути во многих типах опухолей. Активация данного сигнального пути является одним из самых частых и важный молекулярных механизмов в патогенезе меланомы кожи.
Raf-киназы
RAF-протеины (ARAF, BRAF и CRAF) являются серин-треониновыми киназами, эффекторами сиагнального пути MAPK. Каждый из этих протеинов, вероятно, играет роль в физиологической передаче сигнала, однако BRAF имеет ключевую роль в патогенезе меланомы.
Точечные соматические мутации в гене BRAF обнаруживаются в 40-45% случаев меланомы кожи, что делает их самыми распространенными на данный момент онкогенетическими аберрациями для этого заболевания. Самая распространенная мутация (почти 90% BRAF-мутаций) – это трансверсия T → A, которая ведет к замене валина на глутамин в положении 600 (V600E). Стоит отметить, что мутация BRAF V600E обычно не ассоциирована с УФ-воздействием, часто она обнаруживается в меланомах на тех участках кожи, которые не подвергались хроническому УФ-воздействию. Существуют и другие замены, например мутация V600K, на которую приходится почти 5% случаев мутаций BRAF при меланоме, она чаще детектируется в новообразованиях с признаками хронического солнечного повреждения. BRAF V600E является ранним событием при развитии меланомы, данная мутация присутствует в большинстве (почти 80%) доброкачественных и диспластических невусов. Встречаются случаи и других мутаций, не затрагивающих V600. Они обнаруживаются в более чем 20 других участков гена BRAF, однако распространенность их крайне мала (около 5% от общего числа).
BRAF V600E или другая замена в положении V600 характеризуется более чем 20-кратным повышением индукционной активностью киназы в сравнении с диким типом BRAF (in vitro). Мутации других участков могут обладать высокой, средней или низкой каталитической активностью. В любом случае, все эти мутации являются причиной повышенной активации MEK и ERK сигналинга. Вероятно, это происходит и с низко-активными мутациями из-за конформационных изменений, которые способствуют формирования гетеродимера с другими изоформами RAF, такими как CRAF, в комплексе с белками RAS.
Мутация BRAF V600E обладает высокой каталитической активностью и является наиболее распространённой при меланоме кожи, однако ряд доказательств свидетельствуют о том, что данный молекулярный механизм не может до конца объяснить патогенез и тяжесть этого заболевания. На моделях рыбок данио-рерио трансгенная экспрессия BRAF V600E в меланоцитах вызвала доброкачественные невусоподобные образования, в то время как инвазивные формы меланомы были выявлены только при скрещивании с особями, имевшими дефицит p53. Индуцируемая экспрессия только лишь BRAF V600E в меланоцитах мышей ведет к появлению кожной пигментации и невусов с признаками старения без тенденции к инвазии. Экспрессия BRAF V600E в условиях инактивации INK4A также оказалась причиной гиперплазии меланоцитов без инвазивного роста. Было показано, что врожденные невусы человека с активирующими BRAF мутациями экспрессируют кислую β-галактозидазу, которая является классическим маркером старения. Таким образом, предполагается, что наличие только лишь активированного белка BRAF недостаточно для индукции туморогенеза в стадии невуса. Этот вывод также был подкреплен анализом инвазивных меланом, развившихся непосредственно из невусов. Результаты показали, что активирующие мутации генов сигнального пути MAPK равномерно представлены в предраковых новообразованиях. Мутация белка p53 напротив была детектирована исключительно в инвазивных формах опухолей, как и нарушение функциональных перестроек гена супрессора опухолей PTEN. Примечательно, что мутация BRAF V600E сопровождала нарушения в гене PTEN и потерю функциональной активности INK4A в меланоцитах мышей при инвазивных метастатических опухолях.
Несмотря на то, что одиночные генетические изменения не могут приводить к трансформации меланоцитов, клиническая значимость мутации BRAF V600E была подтверждена в качестве терапевтической мишени. Более ранние эксперименты на клетках меланомы человека с мутацией BRAF V600E продемонстрировали, что нокдаун гена BRAF путем РНК- интерференции, что в свою очередь ингибирует ERK и вызывает остановку клеточного цикла и/или апоптоз, происходит торможение роста клеток. Эти результаты привели к разработке и тестированию протеинов и селективных ингибиторов BRAF V600E. Согласно исследованиям, два разных селективных ингибитора V600-мутантной формы протеина BRAF (вемурафениб и дабрафениб) показали высокую противоопухолевую активность при меланоме. С помощью обоих препаратов удалось достичь клинического эффекта почти в 50% случаев заболеваний, а в группе с метастатической меланомой с мутацией BRAF V600E контроль заболевания был достигнут в 90%. Важно заметить, что данные препараты не активны у пациентов с диким типом BRAF; более того, множество исследований говорят о возможном росте таких опухолей на фоне приема селективных ингибиторов BRAF. Этот эффект обусловлен парадоксальной активацией сигнального пути MAPK, особенно в тех опухолях, которые имеют активирующую мутацию HRAS. Этот феномен также представляет собой основной механизм пролиферативных кожных повреждений (кератоакантомы и сквамозно-клеточные карциномы), что является одним из самых распространенных нежелательных эффектов BRAF-ингибиторов. Однако этот эффект может быть устранен с помощью комбинации селективных ингибиторов BRAF и ингибиторов MEK, что было показано на доклинических моделях и пациентах. Ингибиторы MEK также могут решить проблему с резистентностью к селективным ингибиторам BRAF, поэтому рекомендуется совместное применение этих препаратов. Множеством исследований было продемонстрировано, что именно комбинирование селективных ингибиторов BRAF и ингибиторов MEK дает лучший эффект у пациентов с метастатической меланомой, положительной на BRAF V600E.
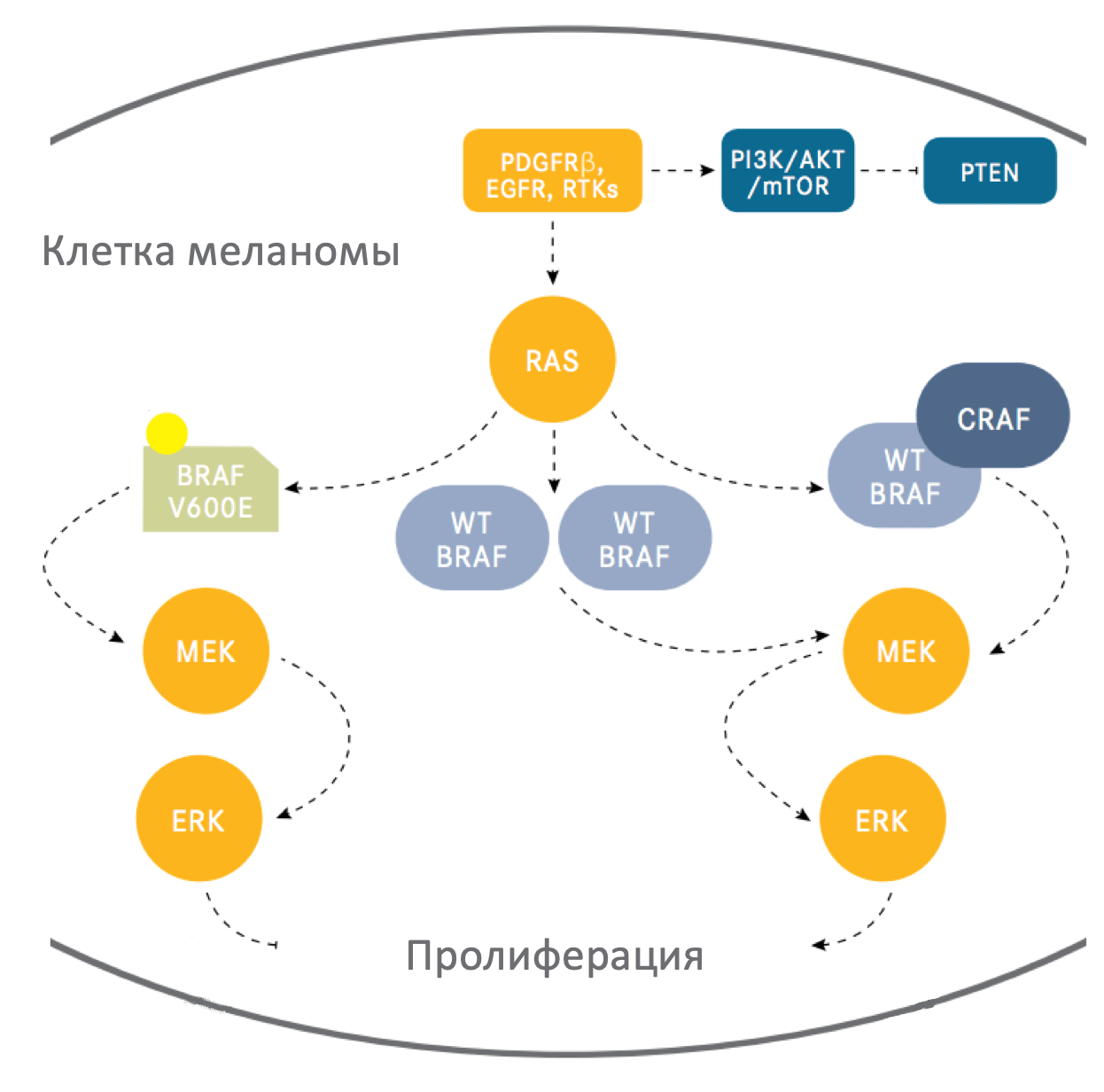
По результатам доклинических исследований СRAF тоже может иметь функциональную значимость при меланоме. Клетки с активирующей мутацией в гене NRAS, по-видимому, преимущественно используют CRAF для передачи сигналов MEK и ERK. Вероятно, в меланомах с BRAF V600E мутацией CRAF не имеет большого значения, однако она играет роль в активации пути через формирование гетеродимера в опухолях без мутаций BRAF. В таком случае CRAF может быть использована в качестве терапевтической мишени. Повышение экспрессии и/или сигналинга через CRAF иногда может быть причиной резистентности к селективным BRAF ингибиторам в меланомах с мутацией BRAF V600E.
Семество ГТФаз RAS
Белки семейства RAS (HRAS, KRAS и NRAS) представляют собой ГТФазы, которые находятся в самом начале каскада MAPK. Активирующие мутации в HRAS и KRAS обнаруживаются во многих типах рака, что позволяет считать данный сигнальный путь значимым для канцерогенеза. Мутации гена NRAS встречаются в 20-25% кожных меланом. Почти 80% мутаций NRAS приводят к замене аминокислоты глутамин в 61 положении (Q61) в 3 экзоне, большинство остальных мутаций затрагивают глицин в положении 12 и 13 (G12, G13) во 2 экзоне. Как и мутации гена BRAF, мутации в NRAS достаточно часто встречаются в невусах. Мутации гена HRAS не характерны для меланомы кожи, но они встречаются при невусе Спитца, редком доброкачественном новообразовании, чаще всего диагностируемом у детей и молодых людей. Мутации в гене KRAS достаточно часто встречаются во многих типах рака, но обнаружить их при меланоме можно чрезвычайно редко. Важно заметить, что мутации в гене NRAS и мутация BRAF V600E являются взаимоисключающими в недавно выявленных меланомах. Однако NRAS мутации являются механизмом резистентности к селективным ингибиторам BRAF, они обнаруживаются почти в 20% BRAF V600E-положительных меланомах в случае прогрессирования заболевания на фоне такого лечения. Часто меланомы с NRAS мутациями сопровождаются неактивирующими (не V600) мутациями гена BRAF.
На моделях мышей Ink4a/Arf-null гиперэкспрессия активированных HRAS и NRAS привела к спонтанному формированию меланомы. Стоит отметить, что HRAS-положительные меланомы достаточно редко дают метастазы, в то время как опухоли с мутациями NRAS часто метастазируют в регионарные лимфатические узлы и отдаленные органы. Роль гена NRAS в туморогенезе меланомы подтверждена на моделях. Нокдаун NRAS в клеточных линиях меланомы человека снижает их жизнеспособность. К тому же, снижение экспрессии NRAS стало причиной регресса меланом, возникших в результате индукции NRAS.
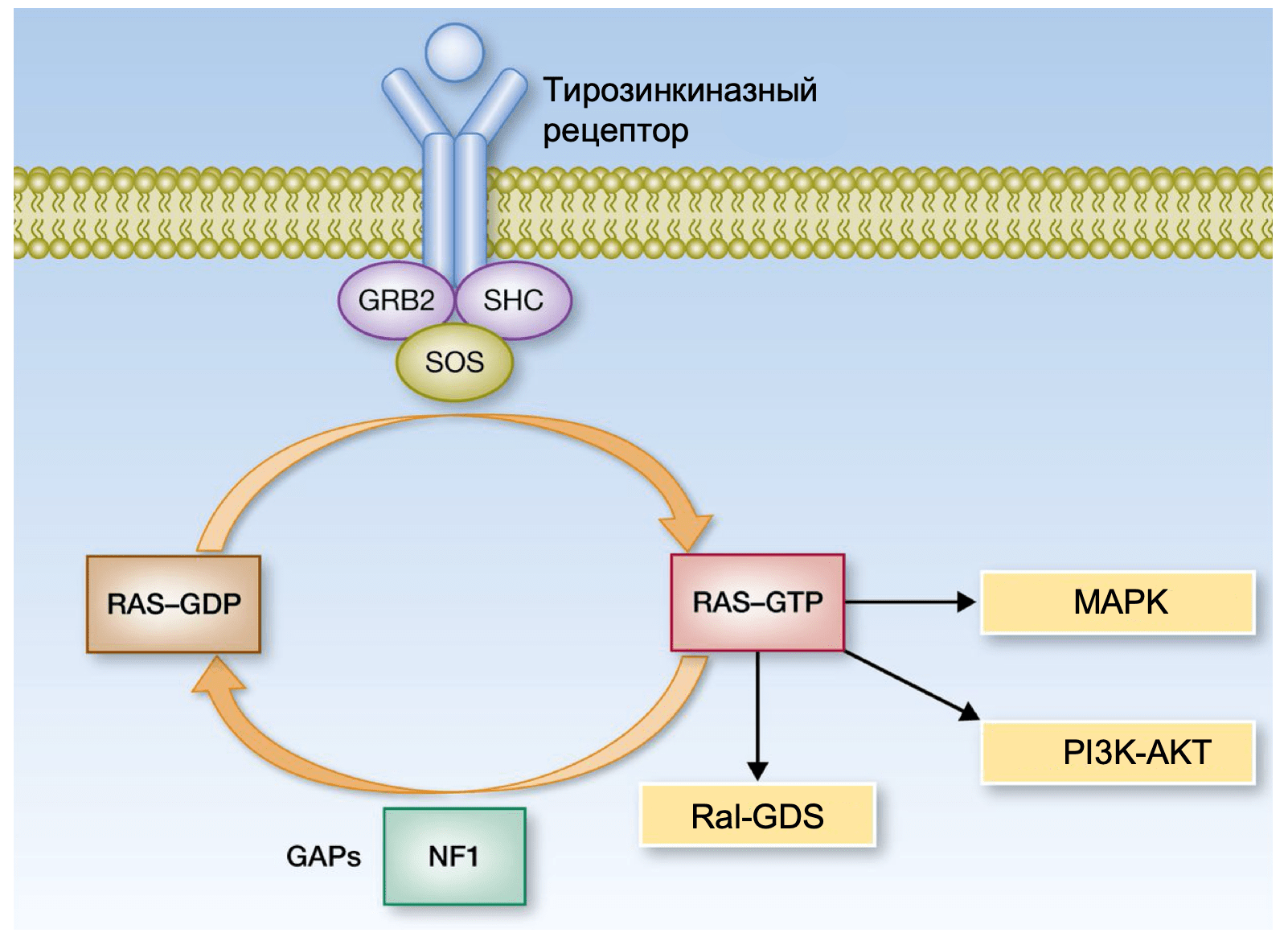
MAPK сигнальный муть может быть активирован потерей гетерозиготности гена NF1. NF1 кодирует белок нейрофибромин, так называемый RAS-GAP, нормальная физиологическая роль которого заключается в супрессии RAS- сигналинга, поэтому нарушения функции NF1 ведут к его дисрегуляции. Такие мутации обнаруживаются почти в 15% меланом кожи и в большинстве случаев они не сочетаются с мутациями в генах NRAS и BRAF. На моделях мышей с помощью генной инженерии показано, что нарушение функции NF1 вместе в другими известными онкогенами оказалось достаточным для индукции меланомогенеза.
Дополнительные онкогенные пути
Активация сигнального пути MAPK – практически универсальный механизм для меланомы кожи и является точкой приложения в терапии, однако и другие сигнальные пути также могут претерпевать изменения
Регуляторы клеточного цикла
Сигнальный путь RB регулирует клеточный цикл. Его значимая роль в патогенезе меланомы связана с обнаружением герминальных мутаций (CDKN2A и CDK4), которые являются самыми распространенными при семейной форме меланомы. Соматические мутации в генах данного сигнального пути также обнаружены во многих образцах меланомы кожи.
Герминативные делеции и активирующие мутации в гене CDKN2A 9p21 хромосомы – наиболее распространённые формы мутаций (составляют почти 40%) при семейной меланоме. К тому же, соматические мутации или делеции, или эпигенетическое сайленсинг генов в этом локусе определяются по меньшей мере в 70% кожный меланом. Таким образом, нарушение функции CDKN2A возможно играет ключевую роль в патогенезе меланомы. Локус CDKN2A имеет необычную генную организацию, которая позволяет выделить 2 транскрипта и продукта гена супрессора опухолей: p16INK4A и p19ARF. Потеря p16INK4A приводит к подавлению супрессора ретинобластомы (RB) путем увеличения активности комплекса циклин-зависимых киназ 4 и 6 (CDK4/6)-циклин D1, в то время как потеря ARF (p14ARF у человека and p19ARF у мыши) понижает активность р53 путем увеличения активности MDM2 (mouse double minute 2). Таким образом, делеция всего локуса ведет к инактивации двух путей онкосупрессии: RB и p53. Гомозиготная делеция экзонов 2 и 3 у мышей является предиктором высокого риска развития меланомы с активацией HRAS в меланоцитах. У пациентов с меланомой, возникшей в результате малигнизации невуса, нарушения регуляции клеточного цикла, в частности в CDKN2A, оказались самыми распространенными генетическими аберрациями при инвазивных формах, однако обнаружить в изначальных невусах такие мутации не удалось.
p16INK4A оказывает ингибирующее влияние на CDK4, который в свою очередь является основным регулятором RB1. У людей, не склонных к развитию меланомы, были обнаружены герминативные мутации CDK4, которые позволяют белку оставаться нечувствительным к ингибированию со стороны INK4A (например Arg24Cys). Исследование меланомы кожи позволило идентифицировать эту мутацию как соматическую (распространенность 2%) наряду с амплификациями гена CDK4 (примерно 4%). CDK4 регулирует клеточный цикл G1/S через контрольную точку путем взаимодействия с циклином D. Знания о генетике опухоли и результаты, полученные с помощью генно-модифицированных мышей, позволяют говорить о комбинации ингибирования обоих сигнальных путей (CDK и MAPK) в меланомах с NRAS мутациями.
CCND1 кодирует киназу D1, которая ингибирует RB путем формирования комплексов с CDK4 и CDK6. Амплификация CCND1 встречается в 5-10% случаев меланомы кожи и является достаточно частой среди опухолей без BRAF и NRAS мутаций.
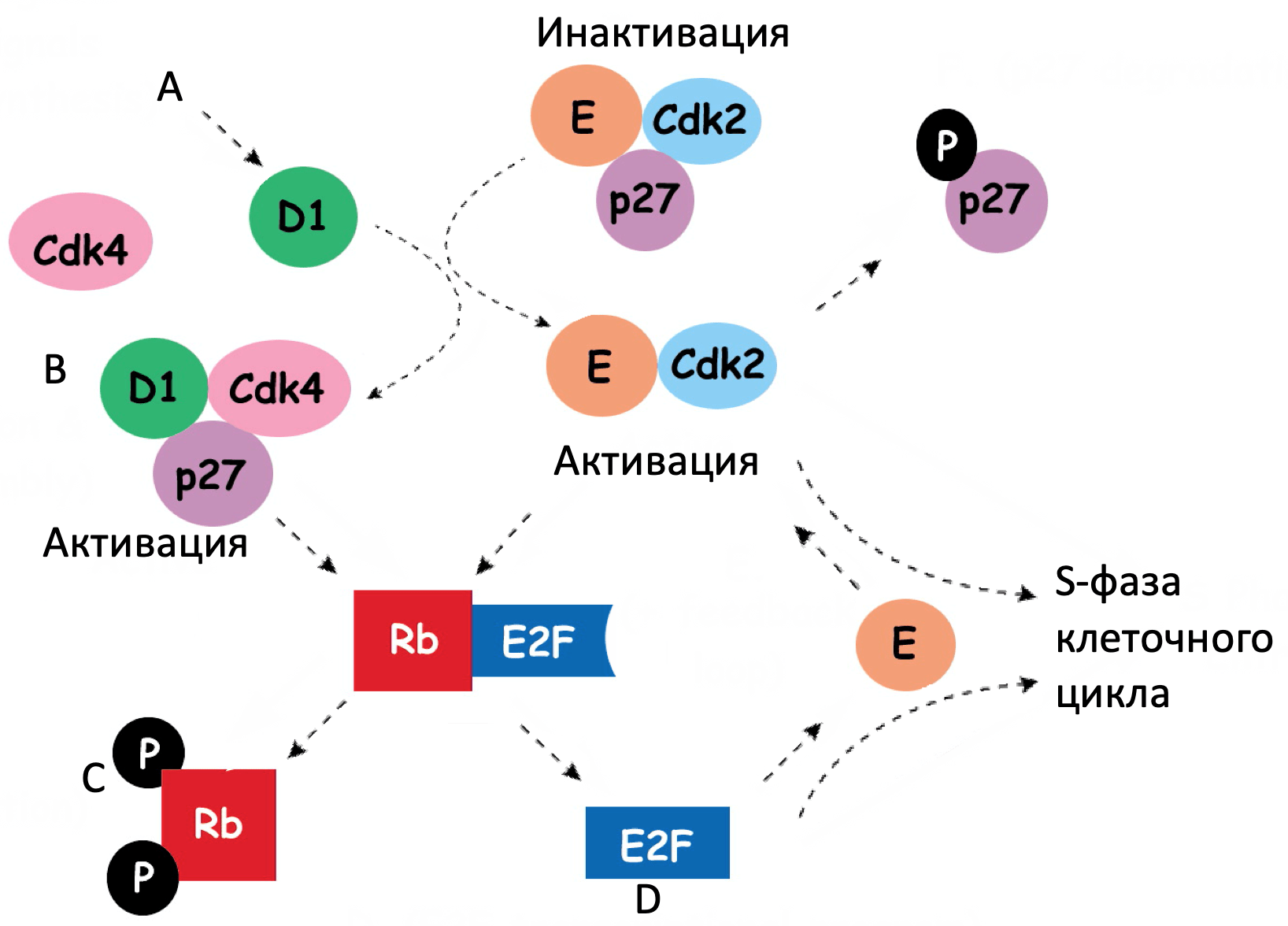
Герминативные мутации в RB1 являются предиктором развития меланомы у пациентов, которые перенесли билатеральную ретинобластому. Такие меланомы демонстрируют потерю гетерозиготности сохранившегося аллеля дикого типа RB1. У этих пациентов риски развития меланомы возрастают от 4 до 80 раз. Среди всех пациентов с кожной меланомой делеция локуса гена RB1 была обнаружена примерно у 3%.
Путь p53
Путь p53 является важнейшим для поддержания стабильности генома с помощью регуляции множества механизмов, включая клеточный цикл, репарацию ДНК и индукцию апоптоза. Мутации в гене TP53 встречается более чем в половине всех опухолей. Ранние исследования предполагали, что мутации в гене TP53 редко встречаются при меланоме кожи, однако полноэкзомные исследования, включая TCGA, обнаружили такие мутации приблизительно в 20% опухолей. В большинстве своем это были опухоли без мутаций или с делеций CDKN2A или р14ARF. Амплификация MDM2, которая влечет за собой ингибирование функции p53, также была обнаружена в опухолях с интактным CDKN2A. При меланоме потеря функции p53 сочетается с активацией BRAF у рыбок данио-рерио, а у мышей- с активацией HRAS. Таким образом, несмотря на достаточно малую распространенность инактивации TP53 при меланоме в сравнении с другими опухолями, нельзя исключить вклад данного события в развитие этого заболевания.
Фосфатидилинозитол-3-киназный путь
Фосфатидилинозитол-3-киназный (PI3K)-AKT путь влияет на активацию онкогенов чаще других сигнальных путей. PI3K фосфорилирует липиды мембраны клетки, вызывая рекрутирование белков, содержащих плекстрин-подобный домен. Одним из ключевых белков, регулируемых PI3K, является серин-треониновая киназа AKT. Фосфорилирование АКТ происходит по двум фрагментам (Ser473 и Thr308), в результате чего активизируется каталитическая активность. Активированные АКТ фосфорилируют множество белков, включая GSK3, P70S6K, PRAS40, BAD и другие белки, отвечающие за клеточные процессы, такие как пролиферация, жизнеспособность, гибель, ангиогенез и метаболизм. Данный сигнальный путь может быть активирован при канцерогенезе двумя способами: активирующими мутациями (PIK3CA, AKT1) или мутациями с потерей функции (PTEN, TSC2). На этот путь оказывают влияние белки семейства RAS, а также многие другие факторы роста и их рецепторы, частота мутаций которых при развитии рака довольна высока. Множественные исследования подчеркивают, что PI3K-AKT сигналинг функционально дополняет RAS-RAF-MAPK при развитии меланомы.
Потеря функции гена супрессора опухолей PTEN является наиболее частой аномалией, которая обнаруживается в сигнальном пути PI3K-AKT при меланоме. PTEN обычно подавляет фосфорилированную АКТ посредством супрессии второго мессенджера- фосфатидилинозитол-3,4,5-трифосфата (PIP3). Потеря функции PTEN приводит к увеличению активности AKT в различных типах рака, включая меланому. Отсутствие экспрессии PTEN обнаруживается в 30% меланомы кожи. Многие исследования показали, что мутации PTEN встречаются в меланомах с активирующими мутациями BRAF, а также в меланомах с диким типом BRAF и NRAS, а в опухолях с мутациями гена NRAS они встречаются крайне редко. Эти комбинации мутаций подкрепляются доклиническими исследованиями, поскольку одновременная потеря функции PTEN и активация BRAF в меланоцитах в 100% случаев приводят к инвазивной, метастазирующей меланоме у генно-модифицированных мышей. Однако только лишь потеря функции PTEN не вызывала изменения фенотипа меланоцитов. Эктопическая экспрессия PTEN при PTEN- дефицитных меланомах позволила снизить активность фосфо-AKT, индуцировать апоптоз, замедлить рост и метастазирование. Анализ клинических образцов совместно с доклиническими исследованиями, подтверждает возможность развития резистентности к таргетной и иммунотерапии меланомы на фоне потери функции PTEN.
Тирозинкиназные рецепторы
Рецепторы тирозинкиназ (RTKs) – разнообразное семейство трансмембранных киназ, которые были обнаружены во многих новообразованиях. Некоторые RTKs при рецидивирующей меланоме исследуют на предмет увеличение числа копий ДНК с соответствующими изменениями в их экспрессии.
Важная роль рецептора KIT и их лигандов (факторы стволовых клеток [SCF]) была показана в патогенезе меланомы. Мутации KIT или SCF приводят к снижению пигментации, а инъекция KIT-блокирующих антител у мышей использовалась для выявления стволовых клеток меланоцитов в волосяных фолликулах. Тем не менее, множественные иммуногистохимические исследования подчеркивают связь между снижения экспресии KIT и переходом доброкачественного новообразования в первичную или метастатическую меланому. Таким образом, на первый взгляд KIT должен быть инактивирован для возникновения меланомы и ее развития. Однако активирующие мутации и амплификация KIT были обнаружены в меланомах кожи с признаками хронического солнечного повреждения, а также в акральных меланомах. Точечные мутации в гене KIT обычно обнаруживаются в тех же участках, что и при гастроинтестинальных стромальных опухолях (ГИСО), где значимость этих мутаций была доказана в том числе клиническим эффектом от KIT ингибиторов. Исследования показали, что мутации KIT могут активировать множество сигнальных путей, в частности и PI3K-AKT. С помощью клеточных линий меланомы с точечными мутациями в данном гене был продемонстрирован эффект KIT ингибиторов: наблюдалось снижение роста клеток и/или апоптоз. На начальных этапах клинических испытаний KIT ингибитора иматиниба у пациентов с активирующими мутациями или амплификацией KIT ответ был получен у 10-30%. Эти показатели выше, чем в предыдущих исследованиях, где не было пациентов с определенным типом меланомы (тогда клинический ответ был получен только у 1% пациентов), но все же намного ниже, чем показатели активности данного препарата у пациентов с ГИСО (70%). Хотя некоторые случаи лечения ингибиторами KIT были не совсем удачны, исследования мутаций KIT продолжаются для большего понимания их значимости и разработки новых подходов к лечению.
Гиперэкспрессия рецептора c-MET и их лигандов, фактора роста гепатоцитов (HGF), коррелирует с прогрессией меланомы. Увеличение количества копий c-MET, расположенной на хромосоме 7q33, ассоциировано с инвазивной и метастатической меланомой у человека, а повышенная экспрессия MET/HGF коррелирует с метастазированием меланомы у мышей. У трансгенных мышей гиперэкспрессия HGF спонтанное возникновение меланомы после длительного латентного периода (2 года); развитие опухоли происходило быстрее под воздействием УФ, а также при дефиците INK4A/ARF. Недавние исследования продемонстрировали, что при меланоме HGF, продуцируемый поддерживающими клетками микроокружения опухоли, также может активировать c-MET. Этот эффект является результатом активации пути PI3K-AKT и способствует развитию резистентности к ингибиторам сигнального пути MAPK.
Секвенирование генов тирозинкиназ показало, что мутации ERBB4 могут встречаться в 20% меланом. В отличие от других хорошо известных онкогенных мутаций, ERBB4 мутации в большинстве своем оказались не рекуррентными (т. е. редко поражалась одна и та же аминокислота или область). Мутации ERBB4 повышали активность собственных рецепторов и PI3K-AKT сигналинга, а также влияли на жизнеспособность соответствующего белка. Несмотря на эти многообещающие открытия, клиническое значение данных мутаций остается не совсем ясным.
Теломеразы
Стабилизация теломер посредством дисрегуляции теломераз давно считается важным механизмом канцерогенеза во многих опухолях. Однако молекулярные механизмы нарушения теломеразной регуляции при злокачественных новообразованиях остаются не до конца изученными. Полногеномное секвенирование меланом привело к неожиданному открытию двух рекуррентных мутаций промотера TERT, который кодирует ключевые каталитические компоненты теломеразного комплекса. Обе мутации генерируют ETS транскрипционные факторы, которые связывают консенсусные последовательности 11 идентичных нуклеотидов. Многие исследования подтвердили высокую частоту мутаций промотера TERT при меланоме и других типах рака, а также факт корреляции этих мутаций с повышенной экспрессией TERT.
Трижды негативные меланомы
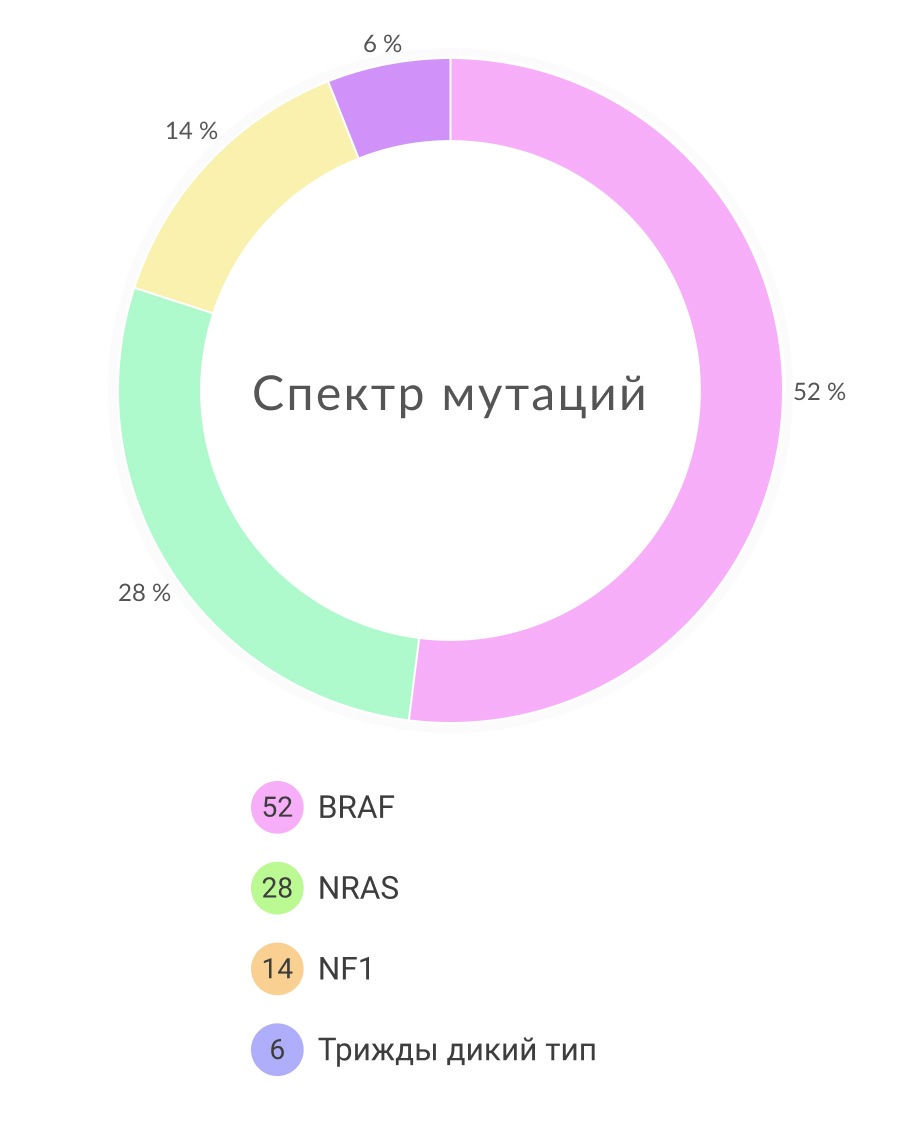
Как описывалось ранее, TCGA продемонстрировали, что большинство кожных меланом имеют мутации в генах BRAF, NRAS и NF1. Была выделена еще одна группа меланом кожи, которая характеризуется отсутствием соматических мутаций в этих трех генах, она названа трижды негативным подтипом. В целом, такие опухоли имеют гораздо меньшую частоту соматических мутаций в генах, которые имеют мутации в общей популяции меланом. Интересно, что для этой подгруппы характерны вариации числа копий онкогенов. Задействованные гены относятся ко многим сигнальным путям, компоненты которых часто подвержены мутациям при других подтипах меланомы, включая RTKs (KIT, PDGFRA, KDR), регуляторы клеточного цикла (CDK4, CCND1) и апоптоза (MDM2), а также TERT.
Путь синтеза меланина
MITF
MITF кодирует транскрипционный фактор, который отвечает за жизнеспособность нормальных меланоцитов. Амплификация MITF является ведущим индуктором развития меланомы. Определение MITF как онкогена происходило с помощью панели клеточной линии NCI-60, представляющей 9 типов опухолей, в которых происходила индукция экспрессии генов и анализ однонуклеотидных полиморфизмов. Амплификация 3p13–14 региона является важным отличием меланомы от опухолей других локализаций, при этом ген MITF являлся единственным геном, который демонстрирует амплификацию и гиперэкспрессию. Амплификация MITF впоследствии была обнаружена в 10% первичных и 15-20% метастатических меланом кожи с помощью флуоресцентной гибридизацией in situ, а также была подтверждена корреляция со снижением 5-летней общей выживаемости. Ингибирование MITF в клеточных линиях привело к снижению амплификации региона 3p13–14, росту и жизнеспособности клеток, а также позволило увеличить чувствительность опухоли к некоторым противоопухолевым препаратам. Деструкция гена MITF привела к дефектам окраски шерсти у мышей, а также к изменению пигментации ввиду снижения жизнеспособности меланоцитов. Совсем недавно было обнаружено, что герминативный вариант (E318K) MITF сопряжен с повышенным риском развития меланомы.
Нижележащие звенья сигнального пути включают как гены пигментных ферментов, так и гены, ответственные за пролиферацию, жизнеспособность и метаболизм. MITF имеет точки соприкосновения с некоторыми известными сигнальными молекулами, включая транскрипционную активацию INK4A, c-MET, и циклин-зависимую киназу 2 (CDK2). Помимо этого, на MIFT оказывают влияние два сигнальных пути: MAPK и c-KIT. Доказана и позитивная регуляция MIFT при меланоме со стороны транскрипционного фактора семейства ETS- ETV1, однако ETV1 может выступать и в роле самостоятельного онкогена в патогенезе меланомы. В совокупности эти наблюдения дают право считать MITF центральным звеном в интеграции сигналов при развитии меланомы.
MC1R сигнальный путь
Пигментация оказывает значительное влияние на предрасположенность кожи к опухолям, поскольку известно, что светлая кожа более чувствительна к солнечной радиации и развитию меланомы. Механизм, лежащий в основе этого наблюдения, частично может быть объяснен протективными свойствами меланина, который синтезируется меланоцитами и доставляется к межфолликулярным кератиноцитам. Фенотип рыжих волос в сочетании со светлой кожей генетически соотносится с вариантом гена рецептора меланоцит-специфического меланокортина 1 (MC1R), который является главным звеном в синтезе меланина. Лигандом для связанного с G-белком MC1R является меланоцит-стимулирующий гормон (MSH), который активирует нижележащие звенья цАМФ-CREB/АТФ1 каскада, результатом которого будет индуцированная экспрессия MITF. Не все люди с данным фенотипом имеют одинаковую продукцию меланина; однако повышенный риск возникновения меланомы остается значительным, не смотря на то, что меланин-независимые механизмы также могут влиять на восприимчивость таких пациентов. В свою очередь, MC1R и цАМФ могут активировать еще не полностью изученные сигнальные пути, такие как MAPK и PI3K.
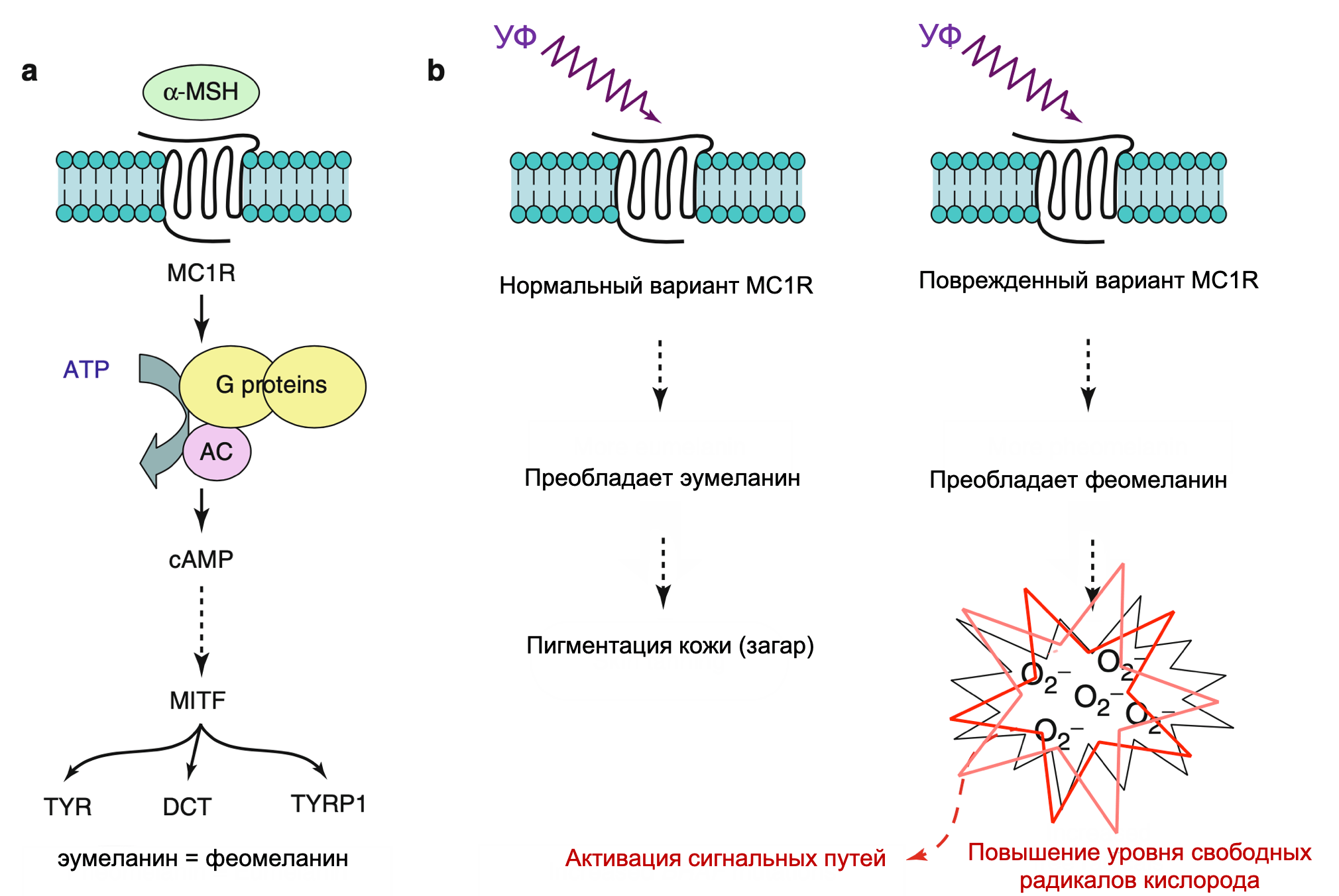
Эксперименты показали, что MSH/MC1R путь связан с нормальной пигментацией кожи в ответ на УФ (загар). Такая реакция связана с определенным риском развития меланомы человека. Модели «рыжих» мышей продемонстрировали, что возникновение пигментации в ответ на УФ зависит от MC1R сигналинга, поскольку кератиноциты отвечают на излучение сильно усиливающейся экспрессией MSH. Восстановление фенотипа «светлой кожи» оказалось возможным с помощью введения низкомолекулярных агонистов цАМФ. В результате полученная темная пигментация рыжих мышей явилась защитой от УФ-индуцируемого рака кожи. Последующие исследования показали, что белок супрессор опухолей p53 может функционировать в качестве «УФ-сенсора» в кератиноцитах, отвечая на УФ-ассоциированное повреждение прямой транскрипционной стимуляцией экспрессии MSH.
Заключение
Обнаружение генетических мутаций привело к кардинально новому направлению в лечении опухолей- таргетной терапии. Однако не смотря на обилие подходов к диагностике и терапии, уровень заболеваемости и смертности меланомы кожи растет. Именно поэтому изучение молекулярных механизмов патогенеза меланомы необходимо для возможности оптимизации диагностики и лечения данного заболевания. Понимание молекулярных закономерностей опухоли позволит обнаружить дополнительные диагностические маркеры, а также найти новые точки приложения в терапии меланомы кожи.
| Молекулярное тестирование | Препараты, одобренные на территории РФ, а также используемые в рамках клинических исследований (*) |
| BRAF | ТКИ BRAF/MEK: дабрафениб+траметиниб, вемурафениб+кобиметиниб |
| c-KIT | Ингибиторы с-KIT: иматиниб |
Зеленый — чувствительность к терапии.
| Ген | Краткая информация |
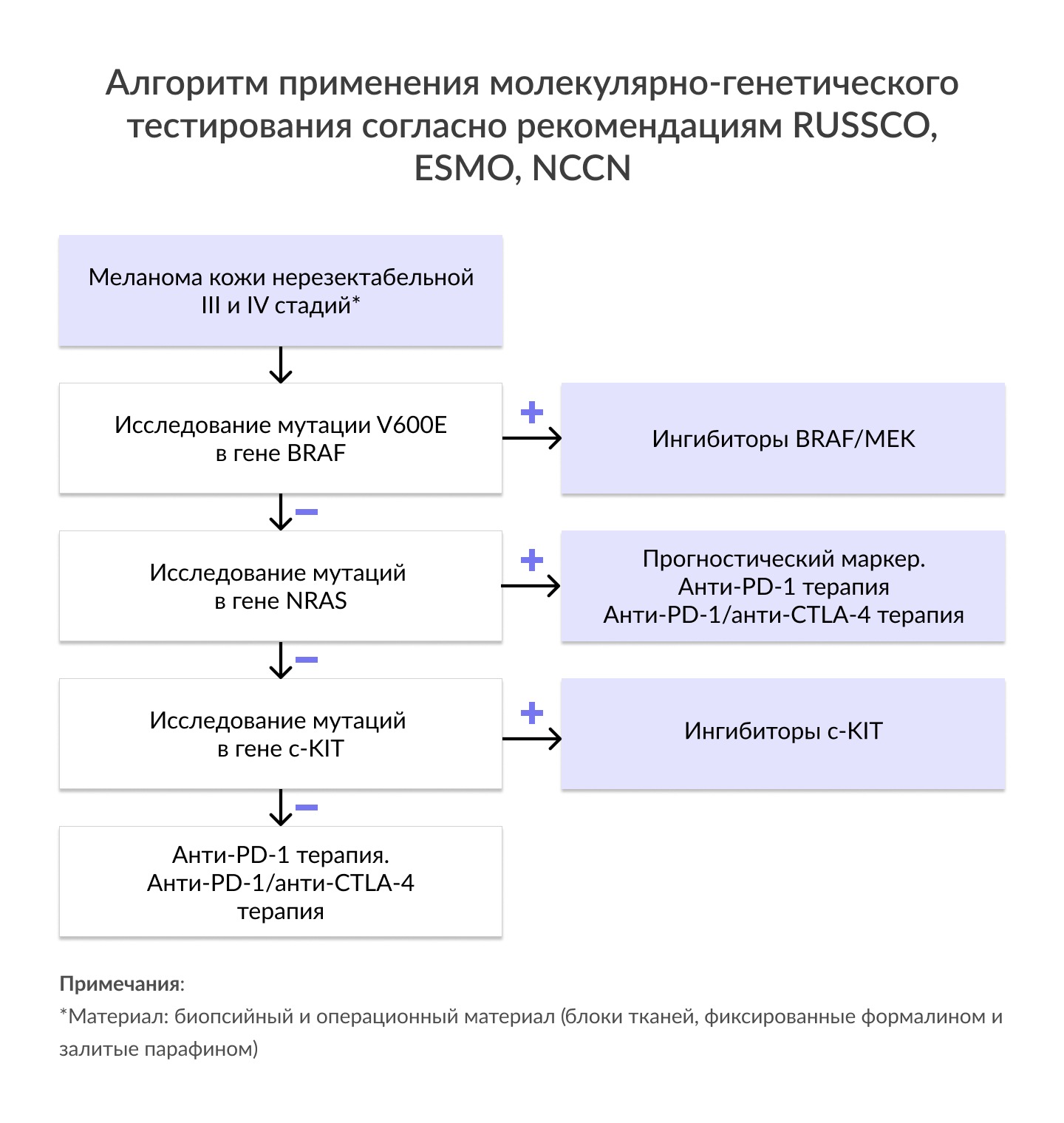
| Мутация V600E в гене BRAF | • Частота мутаций в гене BRAF при поверхностно-распространяющейся меланоме кожи составляет 52-66%, при узловой меланоме- 43-55%; менее часто при меланоме кожи по типу злокачественного лентиго (14-20%) и акрально-лентигинозной меланоме кожи (13-17%). • Мутация V600E наблюдается в 90% всех случаев BRAF- положительных меланом. • Мутации в генах BRAF чаще встречаются при МК без хронического солнечного воздействия (CSD), чем в опухолях, связанных с CSD: 60% против 6-22%, соответственно. Показания: Рекомендовано всем пациентам с меланомой кожи резектабельной и нерезектабельной III стадии и IV стадий для определения показаний к назначению комбинированной таргетной терапии тирозинкиназными ингибиторами BRAF/MEK. |
| Мутации в гене NRAS | • Распространенность аберраций в гене составляет около 15-30% случаев МК. • Мутации в генах NRAS чаще встречаются при меланоме кожи без хронического солнечного воздействия (CSD), чем в опухолях, связанных с CSD: 20-22% против 0-15%, соответственно. • Наличие мутации в гене NRAS ассоциировано с низкой выживаемостью у пациентов с меланомой кожи I-IV стадии. • За исключением редких случаев причин резистентности к терапии BRAF-ингибиторами, активирующие мутации в генах BRAF, NRAS и c-KIT являются взаимоисключающими. Показания: Рекомендовано пациентам с меланомой кожи нерезектабельной III стадии и IV стадии для возможности персонализации терапии (ESMO, 2019). |
| Мутация в гене c-KIT | • Мутации в гене c-Kit наблюдаются в 10-15% случаев меланом слизистых оболочек и акральных лентигинозных меланом, а также в 2-3% случаев меланомы кожи, возникшей в результате хронического солнечного воздействия. • Аберрации в гене c-Kit имеют различную чувствительность к KIT-ингибиторам, иматинибу и сунитинибу. • Мутации в 11 и 13 экзонах (W557, V559, L576P, K642E) имеют наибольшую чувствительность к данной группе ингибиторов. • Мутации в 17 экзоне, например, D816H, имеют либо минимальный ответ к данной терапии, либо отсутствие чувствительности к KIT-ингибиторам. Показания: Рекомендовано пациентам с меланомами слизистых оболочек и акральными лентигинозными меланомами для определения возможности применения KIT-ингибитора. |
Список литературы
- DeVita, Vincent T., Jr., Theodore S. Lawrence, and Steven A. Rosenberg. Devita, Hellman, and Rosenberg’s Cancer: Principles & Practice of Oncology. 11th edition. Philadelphia: Wolters Kluwer, 2019.
- Coit DG, Thompson JA, Albertini MR, Barker C, Carson WE, Contreras C, et al. Cutaneous melanoma, version 2.2019. JNCCN J Natl Compr Cancer Netw 2019. doi:10.6004/jnccn.2019.0018.
- Swetter SM, Tsao H, Bichakjian CK, Curiel-Lewandrowski C, Elder DE, Gershenwald JE, et al. Guidelines of care for the management of primary cutaneous melanoma. J Am Acad Dermatol 2019. doi:10.1016/j.jaad.2018.08.055.
- Rabbie R, Ferguson P, Molina-Aguilar C, Adams DJ, Robles-Espinoza CD. Melanoma subtypes: genomic profiles, prognostic molecular markers and therapeutic possibilities. J Pathol 2019. doi:10.1002/path.5213.
- Leonardi, G.C., Falzone, L., Salemi, R., Zanghì, A., Spandidos, D.A., Mccubrey, J.A. … Libra, M. (2018). Cutaneous melanoma: From pathogenesis to therapy (Review). International Journal of Oncology, 52, 1071-1080.
