Микросателлитная нестабильность
Микросателлиты (короткие тандемные повторы (STR), или простые повторяющиеся последовательности (SSR)) – короткие некодирующие последовательности ДНК длиной 1–6 нуклеотидов, повторяющиеся до несколько десятков раз.
Микросателлиты (МС) расположены в основном вблизи концов хромосом, преимущественно в некодирующих регионах. Каждый МС состоит из двух частей: центральной и периферической, при этом специфичность МС в основном обусловлена изменением количества повторов в центральной части.
Микросателлитная нестабильность (MSI) представляет собой молекулярный фенотип дефектной системы репарации ошибочно спаренных нуклеотидов (mismatch repair system – MMR). Такая дефектная система приводит к повышенной частоте возникновения мутаций в геноме.
Можно выделить 3 типа в соответствии с характером MSI: высокий уровень микросателлитной нестабильности (MSI-H), низкий уровень микросателлитной нестабильности (MSI-L) и микросателлитная стабильность (MSS). В соответствии с рекомендациями ESMO MSI-L принято классифицировать как MSS. Таким образом, принято разделять опухоли в зависимости от статуса микросателлитной нестабильности на MSI и MSS.
Опухоли MSI хорошо отвечают на иммунотерапию. FDA одобрило препарат Keytruda (пембролизумаб) для лечения пациентов с MSI / MMR.
Патогенез
MSI возникает из-за дефекта системы MMR и ошибок в процессе репликации гена, что приводит к изменениям в длине микросателлитов.
Дефект системы MMR
Накопление генетических аберраций в генах, ассоциированных с опухолью, является критически важным шагом в злокачественной трансформации. ДНК постоянно подвергается воздействию эндогенных и экзогенных повреждающих факторов; соответственно, точное и своевременное восстановление повреждений ДНК необходимо для поддержания точности и стабильности ДНК. Множественные процессы совместно проводят работу для восстановления различных типов повреждений ДНК. Ключевые типы репарации ДНК включают эксцизионную репарацию оснований, систему MMR, репарацию путем гомологичной рекомбинации, негомологичное соединение концов и репарацию межцепочечных перекрестных связей.
Среди различных механизмов репарации ДНК MMR играет ключевую роль в поддержании точности репликации ДНК и стабильности генома. Система репарации неспаренных оснований (MMR) – это система, состоящая как минимум из 4 основных белков (MLH1, MSH2, MSH6 и PMS2), работа которой направлена на поиск несоответствий в молекуле ДНК и их устранение.
У эукариот MMR распознает несовпадения с помощью двух белковых комплексов:
- MutSα (гетеродимер белков MSH2 и MSH6)
- MutSβ (гетеродимер белков MSH2 и MSH3)
MutSα используется для репарации нуклеотидных замен и небольших (до 3 нуклеотидов) петель, возникших в результате вставки или делеции нуклеотидных цепочек. MutSβ же только удаляет крупные петли (до 13 нуклеотидов).
MutSα или MutSβ связываются с дефектным участком ДНК и впоследствии рекрутируют MutLα (гетеродимер MLH1 и PMS2). MutLα образует комплекс с MutS на месте дефекта.
PCNA (proliferating cell nuclear antigen) активирует латентную эндонуклеазу в субъединице PMS2 MutLα, которая делает надрез ДНК на 5′- конце в области дефекта. После этапа разрезания ДНК рекрутируется экзонуклеаза 1, которая активируется с помощью MSH2 и/или MLH1. Активированная экзонуклеаза 1 катализирует разрезание ДНК в районе дефекта, включая сам дефект и ближайшие к нему нуклеотиды. Образовавшийся однонитевой участок затем достраивается полимеразой δ (стимулированной PCNA), и в дальнейшем разрыв сшивается ДНК-лигазой I.
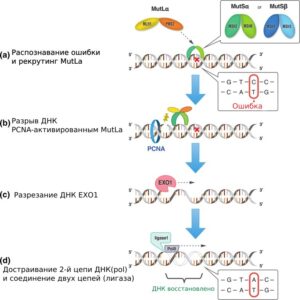
Работа системы MMR включает четыре этапа: распознавание дефекта, разрезание ДНК, удаление дефекта и достраивание/ сшивание цепей ДНК.
(a)MutSα (гетеродимер белков MSH2 и MSH6) или MutSβ (гетеродимер белков MSH2 и MSH3) распознает и связывается с дефектом, и впоследствии рекрутирует MutLα (гетеродимер белков MLH1 и PMS2).
(b) PCNA активирует MutLα, в результате чего происходит разрыв ДНК в области 5′-конца дефекта.
(c) Экзонуклеаза 1 (EXO1) катализирует разрезание ДНК в районе дефекта, включая сам дефект и ближайшие к нему нуклеотиды.
(d) Вырезанный участок ДНК повторно синтезируется полимеразой δ (Polδ), а образовавшийся разрыв сшивается ДНК-лигазой.
Ошибки в процессе репликации гена
В процессе репликации ДНК могут возникать различные ошибки: несоответствия между парами оснований (бывают ошибки спаривания, когда вместо комплементарных пар А-Т, Г-Ц образуются некомплементарные пары), мутации сдвига рамки считывания и проскальзывание полимеразы. В здоровых клетках неспаренные нуклеотиды распознаются и иссекаются с помощью MMR, но в опухолях с MSI этого не происходит.
Повторяющиеся последовательности, такие как микросателлиты, имеют склонность к «проскальзыванию» полимеразы (slipped strand mispairing- SSM). В процессе репликации и синтеза ДНК область микросателлитной повторяющейся последовательности между новой цепью и матричной цепью может быть ошибочно спарена, что ведет к мгновенному разделению этих цепей или формированию стабильной одноцепочечной структуры (шпильки) из повторов. Далее полимераза продолжает достраивать цепь, но из-за шпильки повторяет присоединение нуклеотидов в позиции, к которым уже присоединила ранее. Lai et al. обнаружили, что частота мутаций увеличивается экспоненциально с увеличением количества повторяющихся единиц.
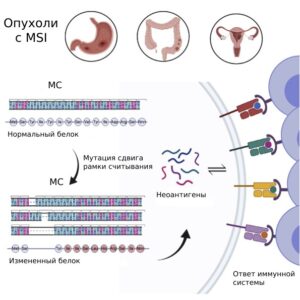
В процессе репликации также могут возникать indel-мутации (insertion/deletion). Клетки с нарушением системы MMR накапливают мутации по всему геному. Большинство МС располагаются в некодирующих регионах. Однако если indel-мутации возникают в МСБ, расположенных в кодирующих регионах, они приводят к мутациям сдвига рамки считывания. Это становится причиной синтеза нефункциональных белков. Это является важным, когда процесс затрагивает онкогены, гены-супрессоры опухолей, гены, ассоциированные с апоптозом, и гены, участвующие в репарации ДНК. Если indel-мутации происходят в МС, расположенных в кодирующих генах-онкосупрессорах, это приводит к инактивации этих генов. Получающиеся в результате мутаций сдвига рамки считывания измененные белки не только лишены нормальной функции, но, кроме того, они представляют собой неоэпитопы, которые представляются молекулами MHC I класса на поверхности опухолевых клеток. Соответственно, мутации сдвига рамки считывания в МС в кодирующих областях являются источником опухолеспецифических неоантигенов. Неоантигены являются мишенью для Т-лимфоцитов. Это обусловливает высокую иммуногенность опухолей с MSI и эффективность применения ингибиторов контрольных точек иммунного ответа.
В настоящее время проводятся исследования конкретных опухолевых мишеней MSI. После анализа большего количества данных с использованием CRISPR-Cas9-опосредованного нокаута и РНК-интерференции Chan et al. показали, что RecQDNA-геликаза WRN является важной частью модели MSI, но не модели MSS. Сайленсинг WRN может индуцировать двухцепочечный разрыв ДНК, активировать ответ на повреждение ДНК, вызывать апоптоз и остановку клеточного цикла. Можно предположить, что WRN может стать мишенью для синтетической летальности.
Клиническое применение
Колоректальный рак
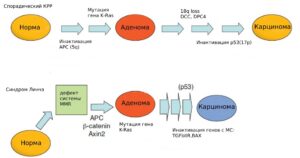
Наиболее часто встречающейся наследственной формой колоректального рака является синдром Линча (наследственный неполипозный рак толстой кишки). Он обусловливает примерно 3% всех случаев КРР и вызван наследственной мутацией в одном из генов системы репарации ДНК: MLH1, MSH2, MSH6, PMS2. У 90% пациентов с синдромом Линча (СЛ) наблюдаются мутации в генах MLH1 и MSH2, у 10% — в гене MSH6, в редких случаях наблюдаются мутации в генах PMS2 и ЕрСАМ. Основная молекулярно-генетическая характеристика опухолей при синдроме Линча— наличие MSI (обнаруживается в более чем в 90% случаев).
Характерными признаками при СЛ являются высокая частота развития метахронного рака и ранний возраст манифестации заболевания. КРР при синдроме Линча, по-видимому, также развивается через трансформацию аденома-карцинома, как и при спорадическом КРР. Однако было высказано предположение, что при СЛ эта трансформация ускоряется, и прогрессирование от аденомы к карциноме может занять от двух до трех лет по сравнению с 8-10 годами в общей популяции.
Существует различные клинические критерии, разработанных для диагностирования данного синдрома.
- В 1991 году были разработаны критерии Амстердам I. Они включают следующие признаки:
1 — наличие трех или более родственников с гистологически подтвержденным КРР, один из которых имеет родство первой степени
2 — наличие КРР по крайней мере в двух поколениях
3 — у одного или нескольких родственников КРР развился в возрасте до 50 лет
4 —семейный аденоматозный полипоз (САП) исключен
- В 1999 году были приняты обновленные, более точные критерии Амстердам II. В них дополнительно добавили наличие опухолей внекишечной локализации, наиболее часто наблюдаемых при СЛ, в частности рак эндометрия, тонкой кишки, мочевыводящих путей (мочеточника или почки)
- Также с 1996 г. в клинике применяются рекомендации Bethesda. Данные критерии были разработаны для того, чтобы идентифицировать пациентов, которым следует провести молекулярно-генетическое исследование (определение MSI). Пересмотренные рекомендации Bethesda включают в себя следующие критерии:
1-КРР развился у пациента младше 50 лет.
2-Наличие синхронного, метахронного колоректального рака или опухолей, ассоциированных с синдромом Линча*, независимо от возраста.
3-КРР с фенотипом MSI у пациентов в возрасте до 60 лет.
4- КРР у пациента, у которого есть родственник первой линии родства с опухолью, ассоциированной с синдромом Линча (при развитии заболевания до 50 лет)
5- КРР у пациента, у которого есть два или более родственника первой или второй линии родства с опухолями, ассоциированными с синдромом Линча (независимо от возраста)
* опухоли, ассоциированные с синдромом Линча: колоректальный рак, рак эндометрия, рак желудка, рак яичников, рак поджелудочной железы, рак мочеточника, рак почки, опухоли билиарного тракта, опухоли ЦНС, аденомы сальных желез, кератоаконтомы, рак тонкой кишки.
При соответствии пациента критериям Амстердам II/Bethesda выполняется NGS-тестирование для определения синдрома Линча.
Кроме того, ранняя диагностика может помочь принять меры профилактики: скрининговые исследования (рекомендовано проведение колоноскопии 1 раз в год либо 1 раз в 2 года, начиная с 20–25-летнего возраста) снижают риск развития рака, связанного с синдромом Линча. Järvinen и др. провели исследование, сравнивающее колоноскопический скрининг (трехлетние интервалы) с отсутствием скрининга у пациентов с СЛ. Результаты показали, что скрининг значительно снизил общую смертность (8% у пациентов, прошедших скрининг, по сравнению с 22% в контрольной группе).
Было высказано предположение, что ранний прием нестероидных противовоспалительных препаратов (НПВП) (например, аспирин) снижает риск развития КРР. Недавно Burn et al. сообщили результаты исследования длительного приема аспирина у пациентов с СЛ на частоту возникновения КРР. Исследование включало 861 человека, средний срок наблюдения составил 56 месяцев. Авторы показали, что прием аспирина в дозе 600 мг в день значительно снижает частоту КРР у пациентов с мутациями генов hMSH2 и hMLH1. Механизмы, с помощью которых аспирин предотвращает развитие рака, неизвестны, однако есть предположения, согласно которым аспирин оказывает проапоптическое влияние на ранних стадиях развития КРР. Однако в настоящее время данный подход в профилактике не одобрен на территории РФ.
Также микросателлитная нестабильность обнаруживается в 10-15% спорадических случаев КРР. Для опухолей с MSI характерны проксимальная правосторонняя локализация, наличие муцинозного компонента, низкая степень дифференцировки. Несмотря на то, что гистологически опухоли часто низкодифференцированные, у пациентов с MSI более благоприятный прогноз выживаемости по сравнению с больными спорадическим раком при одинаковых стадиях развития опухоли.
При II стадии колоректального рака частота опухолей с MSI – 15%, при IV- 1-4%. Такое различие в распространенности подразумевает более низкую склонность к метастазированию опухолей с МСН.
Было показано, что выживаемость пациентов с КРР с MSI выше, чем у пациентов с MSS КРР. Наличие MSI у пациентов со II стадией заболевания ассоциировано с хорошим прогнозом. Было показано, что пациенты с I и II стадией КРР MSI имеют высокие показатели 5-летней выживаемости, низкую частоту рецидивов, однако пациенты с III стадией КРР MSI имеют неоднозначные результаты. КРР с MSI характеризуются такими чертами как выраженная правосторонняя локализация, лимфоцитарная инфильтрация, низкая степень дифференцировки. Saeterdal et al. показали, что опухоли у пациентов с MSI-положительным КРР по сравнению с опухолями MSS, инфильтрированы цитотоксическими Т-клетками.
Статус MSI играет важную роль в определении терапии КРР. В рекомендациях NCCN еще с 2011 г. перед использованием 5-фторурацила (5-ФУ) в качестве адъювантной терапии у пациентов с колоректальным раком (КРР) рекомендуется определение MSI. Sargent др. показали, что монотерапия 5-ФУ в качестве адъювантной химиотерапии у пациентов со II стадией КРР с MSI не продемонстрировала преимущества в показателях выживаемости. NCCN не рекомендует использование адъювантной химиотерапии фторпиримидинами у пациентов с КРР II стадии с наличием MSI.
В то же время исследование Benson et al. показало, что статус MSI у пациентов с КРР III-IV стадий не влияет на результат лечения 5-ФУ. Независимо от статуса MSI, 5-ФУ является эффективным у пациентов с КРР III-IV стадий.
Наличие MSI является показанием для назначения иммунотерапии у пациентов с метастатическим КРР. Исследования показали, что эффективность ингибиторов PD-1 в отношении солидных опухолей с MSI выше по сравнению с таковыми с MSS из-за того, что опухолевые клетки c MSI продуцируют гетерологичные антигены, которые легко распознаются Т-клетками. Так, пембролизумаб был первым одобренным FDA препаратом для лечения солидных опухолей с MSI. MSI можно использовать в качестве единственного предиктора эффективности иммунотерапии в настоящее время у пациентов с КРР. Позднее FDA одобрило другой ингибитор PD-1, ниволумаб, для пациентов с метастатическим КРР, имеющих фенотип MSI после предшествовавшего лечения фторпиримидином, оксалиплатином или иринотеканом. Также FDA одобрило комбинированную терапию ниволумабом и ипилимумабом, анти-CTLA-4 антителом, в качестве комбинированной терапии метастатического КРР с MSI после предшествующего лечения оксалиплатином, иринотеканом и фторпиримидином. Результаты исследования CheckMate-142 показали, что низкие дозы ипилимумаба в сочетании с ниволумабом могут уменьшить токсические и побочные эффекты и могут также оказывать лучший терапевтический эффект у пациентов с метастатическим КРР.
В исследовании Innocenti et al. показано, что химиотерапия в сочетании с цетуксимабом была значительно менее эффективной, чем химиотерапия+Бевацизумаб в лечении пациентов с MSI. Авторы предположили, что причины различной эффективности бевацизумаба и цетуксимаба следующие: сниженная эффективность ингибитора EGFR (цетуксимаба) обусловлена метиляторным фенотипом спорадической опухоли с MSI, что приводит к низкой экспрессии EGFR. Бевацизумаб при лечении пациентов с фенотипом MSI более эффективен, чем цетуксимаб, поскольку «нормализация» сосудистой сети, вызванная бевацизумабом, может способствовать инфильтрации и активации T-лимфоцитов, тем самым способствуя иммуностимуляции и усиливая противоопухолевый эффект клеточного иммунитета.
Рак желудка
MSI обнаруживается примерно в 8-25% случаев рака желудка. Согласно молекулярной классификации TCGA рак желудка можно разделить на четыре подгруппы в зависимости от его молекулярных характеристик: EBV-ассоциированный рак желудка (9% всех опухолей желудка с наличием вируса Эпштейна-Барра), опухоли с микросателлитной нестабильностью (~22%), опухоли с хромосомной нестабильностью (CIN, 50%) и генетически-стабильные опухоли. EBV-ассоциированный рак желудка имеет наиболее благоприятный прогноз, тогда как генетически-стабильные опухоли, напротив, имеют наименее благоприятный прогноз и наиболее слабый ответ на неоадъювантную химиотерапию. У опухолей c CIN и MSI удовлетворительный прогноз, опухоли CIN показывают лучший ответ на неоадъювантную химиотерапию, тогда как опухоли MSI показывают промежуточный ответ на нее.
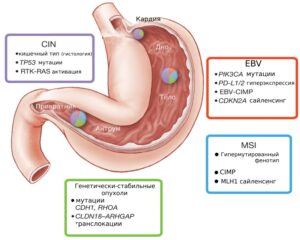
Было показано, что рак желудка c MSI чаще встречается у женщин, ассоциирован с пожилым возрастом, локализацией опухоли в средней / нижней части тела желудка, более высокими показателями выживаемости по сравнению с MSS (что может быть обусловлено высокой иммуногенностью). Типичные гистологические особенности представлены кишечным типом (классификация по Лаурену), наличием муцинозного компонента и выраженной инфильтрацией лимфоидными клетками.
Наличие MSI является показанием для назначения иммунотерапии у пациентов с метастатическим раком желудка. Опухоли с MSI обладают высокой иммуногенностью вследствие большого количества неоантиогенов, индуцирующих противоопухолевый Т-клеточный ответ.
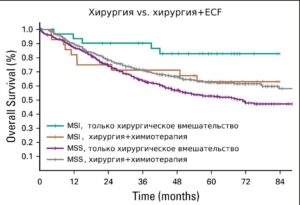
Было показано, что MSI может использоваться в качестве прогностического фактора для резектабельного первичного рака желудка. В исследовании MAGIC у пациентов с операбельным раком желудка сравнивали эффективность только хирургического вмешательства и хирургического вмешательства+ периоперационная химиотерапия (эпирубицин с 5-фторурацилом и цисплатином). Оценивали связь между статусом MSI и общей выживаемостью (ОВ). У пациентов с MSI, которым было проведено только хирургическое лечение, медиана ОВ не была достигнута (95% ДИ, 11,5 месяцев — не достигнуто) по сравнению с медианой ОВ 20,5 месяцев у пациентов с MSS (95% ДИ, 16,7–27,8 месяцев). Напротив, в группе химиотерапия+хирургия у пациентов с MSI медиана ОВ составила 9,6 месяцев (95% ДИ, 0,1–22,5 месяца) по сравнению с медианой ОВ 19,5 месяцев у пациентов с MSS (95% ДИ, 15,4–35,2 месяца; HR 2,18; 95% ДИ 1,08–4,42; P = 0,03). Опухоли с MSI (химиотерапия+хирургия) имели значительно худший прогноз по сравнению с таковыми в группе только хирургического вмешательства. Мета-анализ, объединяющий данные исследований CLASSIC и MAGIC вместе с исследованиями ARTIST и ITACA-S, в которых сравнивались различные стратегии мультимодального лечения желудка, также подтверждает эти результаты. Авторы не обнаружили преимуществ периоперационной/адъювантной химиотерапии у пациентов с MSI. Соответственно, MSI может служить важным маркером для определения терапии на ранних стадиях рака желудка.
Рак тела матки
MSI обнаруживается примерно в 20-30% случаев рака эндометрия, при этом только 2% ассоциированы с синдромом Линча.
Наличие MSI ассоциировано с более молодым возрастом (<60), а также наличием таких клинико-патологических характеристик, как эндометриоидная аденокарцинома, глубина инвазии в миометрий, инвазия в лимфоваскулярное пространство, низкая степень дифференцировки опухоли и Крон-подобная лимфоцитарная реакция. Для опухолей с MSI характерны мутации PTEN, PIK3CA и PIK3R1. У пациентов с эндометриоидной карциномой с MSI наблюдается большее число CD3 + и CD8+ TIL по сравнению с таковыми с MSS.
Международное общество гинекологической патологии (ISGYP) рекомендовало определение статуса MSI во всех случаях рака эндометрия, независимо от возраста.
Определение статуса MSI у пациентов с раком эндометрия необходимо по трем причинам:
(1) в качестве предварительного скрининга для выявления пациентов с повышенным риском синдрома Линча
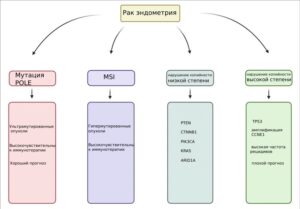
(2) прогностическое значение: согласно классификации TCGA, ультрамутированные опухоли (POLE) имеют наиболее благоприятный прогноз, опухоли с нарушением копийности высокой степени имеют наименее благоприятный прогноз среди четырех молекулярных подгрупп, а опухоли с MSI и опухоли с нарушением копийности низкой степени занимают промежуточное положение. MSI лежит в основе молекулярной классификации, целью которой является дополнение существующих морфологических и клинических данных, определение прогностического риска при каждом из видов мутаций, подбор терапии.
(3) для определения эффективности иммунотерапии: наличие MSI ассоциировано с ответом на терапию ингибиторами контрольных точек иммунитета.
Рак яичников
MSI обнаруживается примерно в 8-17% случаев рака яичников, при этом только 3% ассоциированы с синдромом Линча.
Исследование Howitt et al. показало, что при светлоклеточном раке яичников с MSI наблюдается большее количество CD8+, PD-1 + и TILS по сравнению с таковым MSS. Опухоли с MSI обладают высокой иммуногенностью. Наличие MSI ассоциировано с ответом на терапию ингибиторами контрольных точек иммунитета.
Злокачественные опухоли других локализаций.
Традиционно терапия рака определялась в зависимости от гистологического типа опухоли и ее локализации. С прогрессом в понимании молекулярных механизмов развития рака появилась терапия, независимая от типа опухоли (tumor-agnostic therapy/disease-agnostic therapy). Такая терапия направлена на специфические генетические и молекулярные особенности опухоли независимо от места ее происхождения. Первым биомаркером, определяющим назначение терапии, независимой от типа опухоли (tumor-agnostic therapy), стал статус MSI. 23 мая 2017 года FDA США одобрило анти-PD-1 антитело, пембролизумаб, для лечения пациентов с метастатическими солидными опухолями с MSI, которые прогрессировали на фоне предшествующих режимов химиотерапии и не имеют альтернативных терапевтических опций.
