Рак молочной железы
Рак молочной железы (РМЖ) занимает первое место среди онкологических заболеваний у женщин. Примерно каждая десятая женщина сталкивается с таким диагнозом. РМЖ представляет собой заболевание, при котором клетки молочной железы начинают бесконтрольно делиться. В зависимости от того, какие клетки молочной железы превращаются в опухолевые, распространились ли они за пределы опухоли по организму, влияют ли гормоны на их рост или нет, выделяют различные типы РМЖ.
Какие выделяют типы рака молочной железы в зависимости от того, где находится опухоль?
Молочная железа состоит из трех основных частей: долек, протоков и соединительной ткани. Большинство случаев рака молочной железы начинается в протоках или дольках. Рак молочной железы может распространяться за пределы железы через кровеносные и лимфатические сосуды.
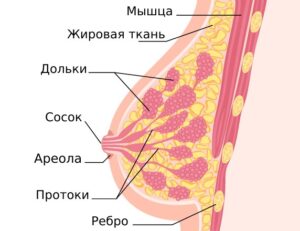
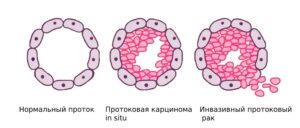
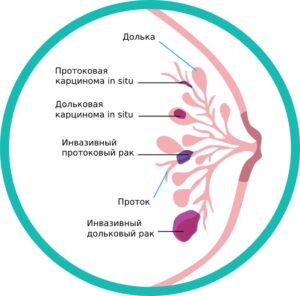
Протоковая карцинома in situ (ductal carcinoma in situ—DCIS) развивается, когда опухолевые клетки появляются в протоках молочной железы и остаются внутри них же («in situ»-на месте). Они еще не приобрели способность распространяться за пределы этих протоков в окружающую ткань молочной железы или в другие части тела. Поэтому у DCIS очень хороший прогноз.
Инвазивный протоковый рак. Наиболее распространенный тип рака молочной железы, который встречается у 80% людей, которым поставлен диагноз РМЖ. «Инвазивный» означает, что рак распространяется за пределы протока, в котором он развился. Опухолевые клетки прорастают в другие ткани молочной железы, а также могут распространяться (метастазировать) в другие органы.
Дольковая карцинома in situ (lobular carcinoma in situ—LCIS)-опухолевые клетки не выходят за пределы дольки молочной железы.
Инвазивный дольковый рак. Опухолевые клетки берут свое начало в дольке молочной железы и прорастают за ее пределы. Они также могут распространяться в другие части тела.
Какие понятия лежат в основе РМЖ?
Эстроген и прогестерон — это половые гормоны, которые в норме вырабатываются у всех женщин. Рост некоторых образований молочной железы усиливается под воздействием этих гормонов. Эти типы опухолей имеют большое количество рецепторов на поверхности клеток: эстрогеновых рецепторов -ЭР и/или прогестероновых-ПР. К ним прикрепляются гормоны, что приводит к стимуляции роста опухоли. Такие опухоли называются гормонозависимыми (ГР+).
Эндокринная терапия (ЭТ) является основным медикаментозным методом лечения пациентов с гормонозависимыми подтипами РМЖ. Например, при лечении ЭР-положительных опухолей (то есть опухолей с наличием эстрогеновых рецепторов) добиваются уменьшения поступления эстрогена в опухоль, что обычно достигается блокировкой ЭР, либо снижением выработки эстрогена. Однако работают такие лекарства не всегда. Одной из причин нечувствительности опухоли к этим препаратам является наличие мутации в гене PIK3CA. Она встречается приблизительно в 40% случаев гормонозависимого РМЖ.
Рецепторы HER2 экспрессируются на поверхности всех клеток и участвуют в нормальных процессах роста, размножения и восстановления клеток. Около 20% случаев рака молочной железы имеют аномально высокие уровни HER2 на поверхности опухолевых клеток и поэтому называются HER2-положительными опухолями. Эти опухоли имеют тенденцию расти быстрее и с большей вероятностью распространяться по организму по сравнению с HER2-отрицательными формами рака молочной железы. HER2-положительный рак молочной железы можно лечить с помощью лекарств, которые блокируют рецепторы HER2, останавливающие неконтролируемый рост опухоли.
Ki-67 – маркер, показывающий, какой процент опухолевых клеток активно делится. Например, если он равен 0%, то ни одна из клеток опухоли в полученном образце не находится в состоянии деления и соответственно опухоль растет медленно, а если Ki-67 равен 100%, то это означает, что все клетки опухоли находятся в состоянии активного деления. Высоким показателем для Ki-67 является ≥ 30 %.
Какова роль генетических событий в развитии РМЖ? И для чего следует проводить молекулярно-генетическое исследование?
Гены — это короткие участки ДНК. ДНК содержит инструкции по построению белков. А белки контролируют структуру и функции всех клеток, составляющих ваше тело.
Гены можно представить как руководство по росту и функционированию клеток. Изменения или ошибки в ДНК похожи на опечатки. Они являются причиной наличия неправильной инструкции, что ведет к нарушению роста или функции клеток. Такие ошибки именуются- мутациями.
Все мутации можно разделить на две большие группы:
- Наследственные мутации передаются от родителей к ребенку и присутствуют на протяжении всей жизни человека в каждой клетке. Наследственная мутация становится причиной развития наследственного рака. Считается, что от 5% до 10% случаев рака молочной железы являются наследственными.
- Приобретенные (или соматические) мутации возникают в течение жизни человека. Их можно найти только в опухолевой ткани, а не во всех клетках организма. Эти изменения могут быть вызваны факторами окружающей среды, такими как ультрафиолетовое излучение, курение, химические воздействия, или могут произойти в случае ошибки во время деления клетки. Приобретенные мутации в клетках молочной железы не могут быть переданы следующему поколению. Соматические мутации являются причиной развития спорадического (ненаследуемого) рака.
Наследственные мутации:
- Мутации в генах BRCA1 и BRCA2
Большинство наследственных случаев рака молочной железы (около 70% случаев) связаны с мутациями в генах BRCA1 и BRCA2.
Название «BRCA» является аббревиатурой от «BReast CAncer gene» («ген рака молочной железы»). BRCA1 и BRCA2 – это два разных гена. Несмотря на их название, гены BRCA не вызывают рак молочной железы. Напротив, эти гены играют большую роль в предотвращении РМЖ.
ДНК в клетках может повреждаться спонтанно или в результате действия определенных факторов (например, избытка воздействия солнечного света). Однако клетки могут сами обнаружить такие повреждения и исправить их. ДНК состоит из 2 нитей. Действие повреждающих факторов могут привести к разрыву либо одной нити, либо сразу двух нитей. Гены BRCA1 и BRCA2 восстанавливают разрывы двух нитей ДНК. Из-за этого гены BRCA известны как гены, подавляющие развитие опухолей. Однако наличие мутаций в генах BRCA1/ BRCA2 приводит к тому, что двунитевые разрывы ДНК не восстанавливаются, что является причиной накопления большого количества ошибок в ДНК. А это в свою очередь является причиной повышенного риска развития рака молочной железы, а также рака яичников.
Мутации в данных генах приводят к значительному увеличению риска развития РМЖ- более чем в 7 раз. Ученые также выявили связь между наличием мутаций в BRCA1 и BRCA2 и некоторыми особенностями опухолей: чаще всего они относятся к трижды негативному подтипу РМЖ (в основном BRCA1), возникают в относительно раннем возрасте, имеют высокий риск поражения второй молочной железы.
В каких случаях рекомендуется определение мутаций в генах BRCA1,2?
Рекомендовано проводить генетическое тестирование на предмет носительства мутаций в генах BRCA 1/2 пациенток при наличии одного из нижеперечисленных критериев:
1. Если рак молочной железы возник в возрасте моложе 45 лет
2. При развитии рака в обеих молочных железах (если опухоль возникла в возрасте 46-50 лет)
3. Если у женщин, у которых рак молочной железы возник в возрасте 46-50 лет, есть родственники с раком молочной железы/яичника/поджелудочной железы/предстательной железы
4. Если есть родственники с раком молочной железы (который возник у них в возрасте младше 50 лет)/раком предстательной железы с метастазами/раком яичника/поджелудочной железы
5. При тройном негативном подтипе рака молочной железы у женщин, у которых рак возник в возрасте младше 60 лет
6. Если у женщины с раком молочной железы есть метастазы (для определения возможности назначения таргетной терапии)
7. Во всех случаях развития рака молочной железы у мужчин
Что означает наличие мутации в генах BRCA у женщин без РМЖ?
Положительный результат теста означает, что у вас есть мутация в одном из генов BRCA1 или BRCA2, и, следовательно, гораздо более высокий риск развития рака молочной железы или рака яичников по сравнению с теми, у кого мутации нет. Но положительный результат не означает, что у вас обязательно разовьется рак. Важно помнить, что даже если опухоль появится, при раннем ее обнаружении результаты лечения хорошие и подавляющее большинство людей продолжает жить полноценной нормальной жизнью.
Существуют определенные подходы для снижения риска развития рака молочной железы у женщин с мутациями в генах BRCA:
- Скрининг рака молочной железы для женщин с мутациями BRCA
Регулярные частые самообследования, начиная с 18 лет, позволяют выявить рак молочной железы на ранней стадии. В случае раннего выявления рака больше шансов на то, что удастся добиться положительных результатов лечения.
Другими мероприятиями, позволяющими выявить РМЖ на ранней стадии, являются:
- Клиническое обследование молочных желез врачом каждые 6–12 месяцев.
- Магнитно-резонансную томографию (МРТ) рекомендуется проводить ежегодно женщинам в возрасте 25–29 лет. Начиная с 30-летнего возраста, рекомендуется ежегодно делать МРТ молочных желез и маммографию.
- Профилактическая мастэктомия
Хирургическое удаление обеих молочных желез называется двусторонней мастэктомией. Операция может снизить риск развития рака молочной железы на 85–100% у женщин с мутацией BRCA. После мастэктомии проводится выполнение реконструкции молочной железы, что позволяет получить удовлетворительный эстетический результат.
- Изменение образа жизни
К способам снижения риска развития рака молочной железы относят регулярную физическую активность (60 минут в день физических занятий средней или высокой степени интенсивности), переход к здоровому питанию, поддержание здорового веса, ограничение потребления алкоголя.
О чем говорит обнаружение мутаций в генах BRCA1/BRCA2 у женщин с РМЖ?
Знание статуса BRCA позволяет врачу выбрать оптимальный способ лечения и более точно определить прогноз заболевания. Используемые методы лечения могут отличаться от таковых у людей, которые не являются носителями данных мутаций.
Так, у людей с мутациями BRCA1 с большей вероятностью разовьется тройной негативный рак молочной железы. Тройной негативный рак не поддается гормональной терапии. Однако химиотерапия может быть более эффективной при лечении таких случаев, чем при других типах рака.
При наличии мутации в генах BRCA1 или BRCA2 у пациентов с РМЖ с наличием метастазов эффективным является применение таргетной терапии (PARP ингибиторы).
Проведение молекулярно-генетического анализа позволяет определить риск развития рака молочной железы, установить наследственную природу мутаций, провести вовремя диагностику и профилактику развития РМЖ у здоровых женщин при положительном ответе, определить прогноз заболевания, правильно подобрать лечение у больных РМЖ. Для проведения данного исследования требуется образец крови пациента. Также выявление мутаций возможно в образце опухолевой ткани (требуются образцы ткани в парафиновых блоках и соответствующие блокам стекла).
Существуют и другие наследственные мутации, которые увеличивают риск развития РМЖ. Они встречаются реже, чем мутации в генах BRCA1 и BRCA2.
- PALB2
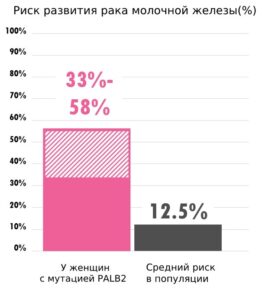
Одним из распространенных, помимо генов BRCA1/2, является ген PALB2. Ген PALB2 в норме защищает нас от рака молочной железы. PALB2, как и BRCA1 и BRCA2, помогает восстанавливать двунитевые разрывы в структуре ДНК. Когда в гене PALB2 возникает мутация, то он не может полноценно выполнять свою функцию. Это ведет к тому, что один из механизмов восстановления повреждений в клетках не работает, что приводит к повышенному риску развития РМЖ.
В случае обнаружения мутации PALB2 необходим скрининг, целью которого является выявление рака молочной железы на ранних стадиях, когда он легче поддается лечению.
В качестве скрининга рака молочной железы при обнаружении мутации в гене PALB2 рекомендовано ежегодное прохождение маммографии и МРТ молочной железы с контрастированием, начиная с 30 лет.
Соматические мутации:
- HER2
Ген HER2 производит белок под названием HER2 (рецептор 2 эпидермального фактора роста человека). Этот рецептор находится на поверхности всех клеток молочной железы и помогает им расти.
Возникновение ошибки в гене HER2 ведет к тому, что он создает слишком много копий самого себя (это называется амплификация). Эти дополнительные гены HER2 производят слишком много белков, известных как рецепторы HER2. Рецепторы похожи на антенны на поверхности клеток молочной железы. В норме рецепторы HER2 получают сигналы, которые стимулируют клетку к росту и делению. Однако клетки рака молочной железы со слишком большим количеством рецепторов HER2 получают слишком много сигналов для роста. Это заставляет клетки молочной железы бесконтрольно расти и делиться слишком быстро, что является причиной неконтролируемого роста клеток.
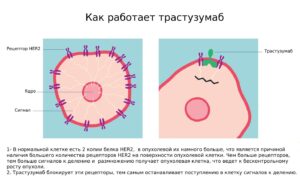
Рак молочной железы с амплификацией гена HER2 называется HER2-положительным. Для HER2-положительного рака молочной железы разработана эффективная таргетная терапия. Примером может служить Трастузумаб — моноклональное антитело, мишенью которого является рецептор HER2. Трастузумаб прикрепляется к рецепторам HER2 на поверхности опухолевых клеток и блокирует их. Таким образом опухолевые клетки больше не могут получать бесконечные сигналы роста, соответственно рост опухоли замедляется или вовсе останавливается. Использование данной таргетной терапии значительно увеличивает продолжительность жизни женщин с HER2-положительным раком молочной железы.
Определение амплификации гена HER2 помогает понять, будет ли эффективна таргетная терапия, которая стала стандартом лечения при РМЖ, у конкретного пациента или нет, поэтому данное молекулярно-генетическое исследование рекомендовано всем пациентам с раком молочной железы.
- PIK3CA
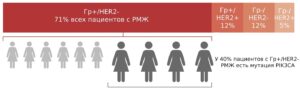
Мутации гена PIK3CA обнаруживаются примерно в 30-40% случаев Гр+/Her2- РМЖ. PIK3CA — ген, который кодирует белок PI3K. В результате мутации PIK3CA изменяется структура белка PI3K, что ведет к патологической активации данного каскада биохимических реакций (сигнального пути PI3K-Akt-mTOR), поэтому клетки начинают бесконтрольно делиться. Данная мутация помогает опухолевым клеткам выживать и расти.
Опухоли с наличием мутации гена PIK3CA как правило нечувствительны к эндокринной терапии. Однако при наличии данной мутации возможно применение таргетной терапии у пациентов с Гр+/HER2- распространенным раком молочной железы. Таргетная терапия (алпелесиб) блокирует сверхактивный путь PIK3CA, в результате чего блокируется рост опухоли.
Молекулярно-генетическое тестирование на наличие мутации PIK3CA позволяет прогнозировать течение заболевания, оценить чувствительность опухоли к препаратам эндокринной терапии и планировать применение таргетной терапии у пациентов с РМЖ с наличие отдаленных метастазов. Для проведения данного исследования требуется образец опухолевой ткани в парафиновых блоках и соответствующие блокам стекла.
- Экспрессия мРНК PD-L1 и микросателлитная нестабильность (MSI)
Cовременным методом лечения метастатического рака молочной железы является иммунотерапия. Иммунотерапия помогает иммунной системе нашего организма находить и убивать опухолевые клетки. В норме наша иммунная система убивает все «плохое», однако опухолевые клетки в процессе эволюции научились маскироваться как «хорошие», вводя иммунную систему в заблуждение и обманом отключая нормальные механизмы защиты нашей иммунной системы. Препараты этой группы воздействуют не на опухоль, а на наш иммунитет, помогая ему обнаружить опасность (опухолевые клетки) и устранить ее. У этого метода лечения хорошая эффективность, однако он работает, если опухоль имеет специфические биомаркеры, такие как микросателлитная нестабильность (MSI), экспрессия PD-L1. Молекулярно-генетическое исследование позволяет выявить эти биомаркеры и определить, будет ли эффективна иммунотерапия у пациентов с метастатическим РМЖ.
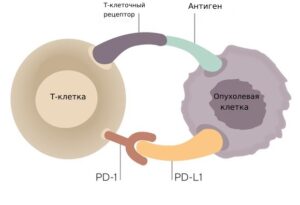
Наша иммунная система имеет сложные механизмы саморегуляции. Они необходимы для соблюдения хрупкого баланса: с одной стороны, не пропустить «чужих агентов», с другой стороны, не атаковать свои собственные клетки и ткани, принимая их за чужие. Одним из таких механизмов являются контрольные точки, которые работают как тормоза для иммунитета. К этому классу веществ относят рецептор PD1 и его лиганд PD-L1. PD-1 – это белок, который располагается на поверхности Т-клеток (клеток нашей иммунной системы). Его лиганд- PD-L1 — это белок, который находится на поверхности нормальных клеток. Когда PD-1 связывается с PD-L1, в Т- клетки поступает команда, что перед ним «свои» и атаковать не нужно. Некоторые опухолевые клетки приспособились и нашли способ обойти нашу естественную защиту: они имеют большое количество PD-L1, что помогает им «нажать на тормоз» и выключить иммунный ответ организма. Иммунотерапия может блокировать это связывание и активировать иммунный ответ против опухолевых клеток. Чтобы понять, поможет ли пациенту c раком молочной железы иммунотерапия или нет, необходимо оценить экспрессию PD—L1 (количество данного белка на поверхности клеток) в опухолевых клетках. Препараты эффективны лишь при повышенной экспрессии данного маркера.
В нашем организме существует сложная система, которая исправляет «поломки» в ДНК. Если один из механизмов ее работы дает сбой, то происходит накопление ошибок по всему геному. Данный феномен носит название микросателлитной нестабильности (MSI). Ученые выяснили, что иммунотерапия эффективна у пациентов с микросателлитной нестабильностью. Дело в том, что нашей иммунной системе легче «увидеть» такие опухоли, и соответственно, уничтожить опухолевые клетки.
Определение MSI и PD-L1 у пациентов с раком молочной железы с помощью молекулярно-генетического исследования является важным, так как необоснованное назначение иммунотерапии недопустимо, потому что препараты могут вызывать довольно серьезные нежелательные явления.
Таким образом, молекулярно-генетическое исследование может позволить врачу подобрать верное и наиболее эффективное лечение персонально для каждого конкретного пациента с раком молочной железы.
