Генетика в онкологии
Тело человека состоит из 30-40 триллионов клеток. И каждая клетка нашего организма содержит ДНК – уникальный генетический код, который программирует всю дальнейшую жизнь клетки. ДНК хранится в ядре клетки, компактно «упакованная» в хромосомы. С ДНК происходит «считывание» информации для синтеза белка (основного строительного материала клетки)- процесса, обеспечивающего рост и развитие клеток, их обмен веществ. Таким образом происходит реализация заложенной генетической программы. Ген представляет собой участок ДНК, кодирующий информацию об одном белке.
Иногда в ДНК отдельных клеток происходят поломки – мутации, что приводит к изменению генетической информации (исходного кода). Эти поломки могут быть вызваны влиянием внешних факторов (воздействием канцерогенов, например, курением) либо произойти «случайно» вследствие ошибки в процессе деления клеток. Генетические дефекты также могут быть унаследованными от родителей (примером наследственных заболеваний могут служить синдром Линча, ретинобластома).
Именно мутации обуславливают превращение нормальных клеток в опухолевые. В результате ошибки в исходной последовательности ДНК происходит считывание неверного кода, что приводит к синтезу неправильного белка, что ведет к нарушению всех процессов в клетке. Клетки, в которых произошли мутации, начинают неконтролируемо расти и делиться. При этом «поведение» опухоли, ее ответ на лечение, зависят в первую очередь от типа генетических «поломок», произошедших при ее появлении и/или дальнейшем развитии. Именно поврежденные гены определяют свойства опухоли.
Для чего нужно генетическое тестирование в онкологии?
Подбор эффективного лечения
Долгие годы лечение рака представляло собой следование определенному шаблону: сперва проводили операцию и удаляли опухоль, затем применяли химиотерапию или лучевую терапию, чтобы убить остаточные опухолевые клетки. Сейчас же врачи могут узнать генетическую последовательность в опухолевых клетках пациента с помощью молекулярно-генетического тестирования: в то время как у нормальных клеток нашего тела идентичные гены, в опухолевых клетках есть мутации, что и позволяет расти опухолям.
Это дает врачу большие возможности в подборе эффективной терапии.
Химиотерапия
Химиотерапия – это воздействие цитостатическими препаратами на клетки опухоли. Принцип действия таких препаратов заключается в попытке убить любые быстрорастущие клетки. Однако при этом поражаются не только опухолевые, но и здоровые клетки. Это может стать причиной появления нежелательных явлений препарата. Химиотерапия относительно универсальна, она может быть назначена практически при всех типах опухоли.
Таргетная терапия
Таргетная терапия используется для лечения многих видов опухолей: рака легкого, поджелудочной железы, печени, молочной железы, почки, колоректального рака и опухолей головы и шеи. В зависимости от типа рака и и ее распространенности таргетная терапия используется для замедления роста опухоли, облегчения симптомов и для уничтожения опухолевых клеток, которые распространились по организму. Перед назначением препаратов врач обсудит с вами цели терапии. Обычно такие препараты принимают в виде таблеток либо проводят внутривенные инфузии.
Такие препараты не наносят большой вред нормальным клеткам, однако для них также характерны нежелательные явления. Они зависят от мишени, на которую воздействуют препараты. Некоторые лекарства нацелены на мишень, которая хоть и встречается чаще в опухолевых клетках, но присутствует и в здоровых клетках. Чем больше у препарата мишеней, тем больше нежелательных явлений он может вызвать.
Таргетная терапия по сравнению с химиотерапией имеет совершенно другой механизм действия. Эти препараты атакуют опухолевые клетки, в частности, стратегически важные мишени, необходимые для выживания клетки, ее деления и метастазирования.
Можно разделить такие препараты на 2 основные группы: препараты антител и малые молекулы.
Препараты на основе антител представляют собой созданные человеком аналоги белков иммунной системы, которые «снаружи» клетки атакуют рецепторы. Рецепторы можно считать антеннами клеток. Они передают сигналы из окружающей среды в клетку. Использование рецепторов в качестве мишеней приводит к предотвращению передачи сигналов выживания опухолевым клеткам. Таким образом, опухолевые клетки не могут получить нужные им сигналы и погибают.
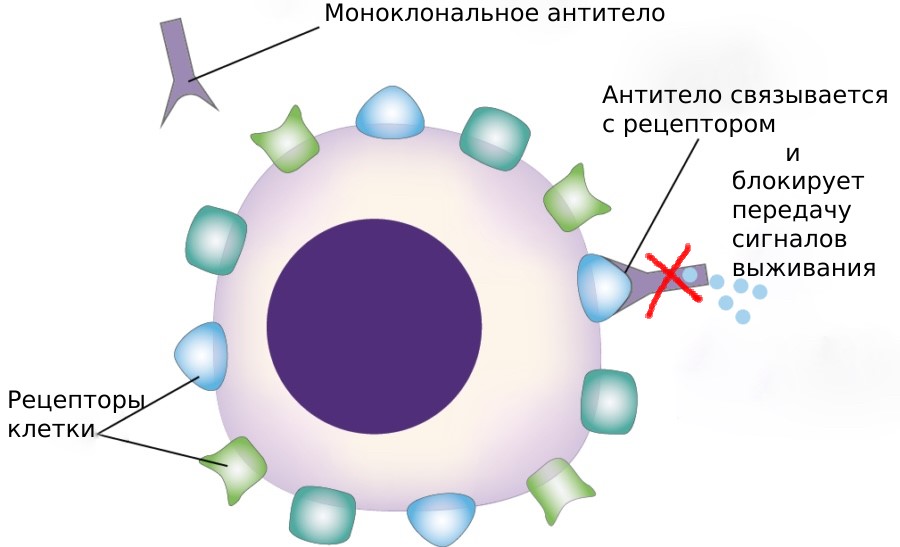
Трастузумаб является моноклональным антителом, нацеленным на рецептор HER2. Использование данной таргетной терапии значительно увеличивает выживаемость женщин с раком молочной железы с высокой экспрессией HER2. Определение экспрессии HER2 в образце ткани (в парафиновых блоках) помогает определить, будет ли эффективен у конкретного пациента данный препарат или нет.
Другими примерами моноклональных антител являются цетуксимаб и панитумумаб, которые были разработаны для лечения рака толстой кишки. В самом начале их применения казалось, что данные лекарства неэффективны, потому что они не помогали многим пациентам. Затем ученые выяснили, что если опухолевая клетка имеет специфическую генетическую мутацию — KRAS, то эти препараты не подействуют.
Таким образом, знание молекулярно-генетических характеристик опухоли помогает врачу в подборе наилучшего персонализированного лечения для пациента и прогнозировании эффективности терапии.
В прошлом онкологу приходилось пробовать каждый вид терапии на каждом пациенте, а затем менять лечение, если опухоль продолжала расти. Сейчас есть возможность провести молекулярно-генетическое исследование и заранее узнать, насколько будет эффективным тот или иной препарат, и подействует ли он вообще.
Вторая группа препаратов таргетной терапии по своей структуре не является антителами. Поскольку антитела представляют собой большие молекулы, эту группу назвали «малыми молекулами». Они атакуют опухолевые клетки «изнутри», блокируя жизненно важные внутриклеточные механизмы и тем самым предотвращая передачу сигналов, необходимых для выживания опухоли.
Примером препаратов этой группы является иматиниб, который используется при лечении ГИСО (гастроинтестинальной стромальной опухоли-редкой опухоли ЖКТ) и некоторых видов лейкоза. Мишенью иматиниба являются аномальные белки (ферменты), которые образуются на опухолевых клетках и внутри них, и способствуют неконтролируемому росту опухоли. Блокирование этих ферментов подавляет рост опухолевых клеток.
Другим примером является гефитиниб. Он применяется для лечения метастатического немелкоклеточного рака легкого. Этот препарат в качестве мишени использует внутриклеточную часть EGFR. EGFR представляют собой рецепторы, которые находятся на поверхности многих нормальных клеток, но в некоторых опухолевых клетках их гораздо больше. EGFR воспринимает сигнал, который дает команду клетке расти и делиться. Когда гефитиниб блокирует этот сигнал, это приводит к замедлению либо остановке роста клеток. Однако гефитиниб работает не у всех пациентов, а только у пациентов с определенным генетическим подтипом.
Примерно у 10% пациентов есть такие генетические изменения. Такие мутации приводят к тому, что рецептор EGFR всегда включен, и поэтому клетке подается непрерывный сигнал к росту и делению. Гефитиниб отключает этот сигнал и останавливает рост клеток у данной группы пациентов. К сожалению, эти мутации являются довольно редкими и в основном встречаются у некурящих женщин, что составляет меньшинство пациентов с раком легкого.
Похожим примером может служить применение кризотиниба. У пациентов с транслокациями ALK (редкий тип мутаций, который в основном встречается у некурящих) при лечении этим препаратом происходит быстрое уменьшение размеров опухоли. Еще одним примером препаратов является сунитиниб. Он используется для лечения рака почки и некоторых ГИСО. Это лекарство считается многоцелевым таргетным препаратом, потому что блокирует фактор роста эндотелия сосудов (VEGF) и другие мишени, что замедляет рост опухоли и не дает ей образовывать свои собственные кровеносные сосуды, которые нужны опухоли для роста и метастазирования. В данном случае еще не существует биомаркеров, которые бы помогли определить, кому поможет препарат, а кому нет.
Иммунотерапия
Еще одним современным методом лечения является иммунотерапия. Иммунотерапия помогает иммунной системе нашего организма находить и убивать опухолевые клетки. В норме наша иммунная система убивает все «плохое», однако опухолевые клетки в процессе эволюции научились прикидываться «хорошими», вводя иммунную систему в заблуждение и обманом отключая нормальные механизмы защиты и распознавания. Препараты этой группы воздействуют не на опухоль, а на наш иммунитет, помогая ему обнаружить опасность (опухолевые клетки) и устранить ее. У этого метода лечения хорошая эффективность, однако он работает, если опухоль имеет специфические биомаркеры, такие как микросателлитная нестабильность (MSI), экспрессия PD-L1.
Наша иммунная система имеет сложные механизмы саморегуляции. Они необходимы для соблюдения хрупкого баланса: с одной стороны, не пропустить «чужих агентов», с другой стороны, не атаковать свои собственные клетки и ткани, принимая их за чужие. Одним из таких механизмов являются контрольные точки, которые работают как тормоза для иммунитета. К этому классу веществ относят рецептор PD1 и его лиганд PD-L1. PD-1 – это белок, который располагается на поверхности Т-клеток (клеток нашей иммунной системы). Его лиганд- PD-L1 — это белок, который находится на поверхности нормальных клеток. Когда PD-1 связывается с PD-L1, в Т- клетки поступает команда, что перед ним «свои» и атаковать не нужно. Некоторые опухолевые клетки приспособились и нашли способ обойти нашу естественную защиту: они имеют большое количество PD-L1, что помогает им «нажать на тормоз» и выключить иммунный ответ организма. Ингибиторы контрольных точек (ИКТ, антитела, которые нацелены на PD-1 или PD-L1) могут блокировать это связывание и активировать иммунный ответ против опухолевых клеток. Чтобы понять, помогут ли пациенту ИКТ или нет, при некоторых типах опухолей необходимо оценить экспрессию PD—L1 (количество данного белка на поверхности клеток) в опухолевых клетках. Препараты эффективны лишь при повышенной экспрессии данного маркера.
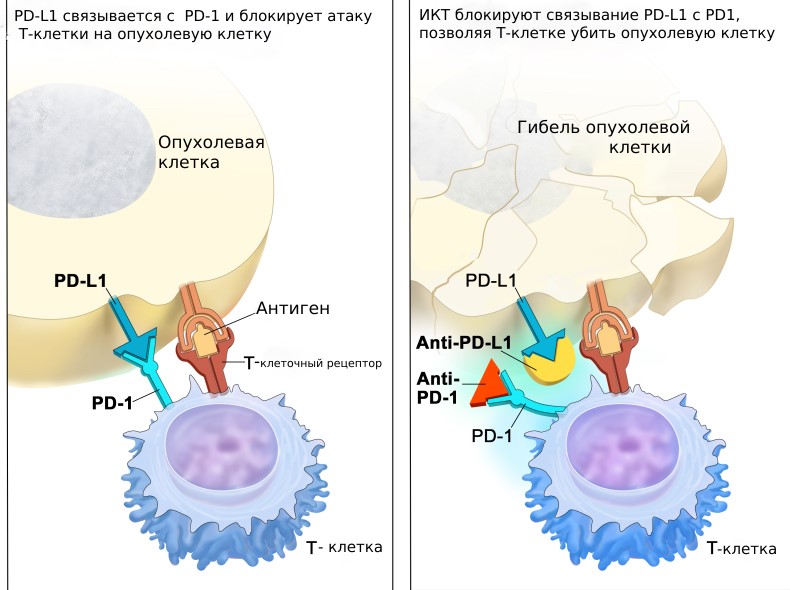
В нашем организме существует сложная система, которая исправляет «поломки» в ДНК. Если один из механизмов ее работы дает сбой, то происходит накопление ошибок по всему геному. Данный феномен носит название микросателлитной нестабильности (MSI). Ученые выяснили, что иммунотерапия эффективна у пациентов с микросателлитной нестабильностью. Дело в том, что нашей иммунной системе легче «увидеть» такие опухоли, и соответственно, уничтожить опухолевые клетки. Определение микросателлитной нестабильности рекомендовано всем пациентам с колоректальным раком для возможности назначения иммунотерапии.
Определение MSI и PD-L1 с помощью молекулярно-генетического исследования является важным, так как необоснованное назначение иммунотерапии недопустимо, потому что препараты могут вызывать довольно серьезные нежелательные явления.
Невозможно выделить из перечисленных выше методов лечения самый эффективный, поскольку чувствительность опухоли к тем или иным препаратам определяется биологией опухоли, которая индивидуальна у каждого пациента. Поэтому одна и та же терапия может работать у одного пациента, и совершенно не работать у другого. Таким образом, генетическое исследование может позволить врачу подобрать верное и наиболее эффективное лечение персонально для каждого конкретного пациента.
Кроме того, генетическое исследование позволяет определить риск развития нежелательных явлений при применении некоторых препаратов в лечении опухолей, то есть определить их профиль токсичности. Это позволяет либо вовремя прекратить прием препарата, либо снизить расчетную дозировку, тем самым появление нежелательных явлений химиотерапии, либо повысить дозу, что может увеличить эффективность лечения.
Определение прогноза течения заболевания
Генетическое тестирование позволяет определить прогноз течения заболевания. Дело в том, что некоторые мутации являются маркерами неблагоприятного течения заболевания, повышенного риска метастазирования опухоли и рецидива. Соответственно с этим, врач может выбрать оптимальную тактику лечения: сохранить орган при выполнении операции или удалить его, использовать дополнительные препараты после операции или ограничиться наблюдением.
Примером может служить лечение пациентов с опухолями щитовидной железы. Определение мутаций BRAF V600E и TERT помогает определить объем операции, выявить группы риска, что необходимо для выбора оптимальной послеоперационной тактики ведения пациента и дальнейшего назначения радиойодтерапии.
Профилактика и скрининг
Генетическое тестирование может быть полезно здоровым людям с семейной онкологической предрасположенностью для определения риска развития заболевания и проведения профилактических мероприятий. Например, у женщин с мутацией BRCA1 присутствует высокий риск развития рака молочной железы. Соответственно, женщине-носительнице мутации рекомендуется постоянное наблюдение у врача, выполнение магнитно-резонансной томографии, более раннее проведение маммографии, в некоторых случаях ставится вопрос о профилактической мастэктомии. Эффективность ранней диагностики высока и при синдроме Линча (наследственном неполипозном раке толстой кишки). Здоровым носителям мутаций рекомендуют проведение колоноскопии (в 20-25 лет каждые 2 года, в 40 лет раз в год).
Таким образом, своевременно проведенное генетическое тестирование позволяет вовремя выявить опухоль либо снизить риск развития рака.
Диагностика
Наконец, генетическое тестирование позволяет диагностировать онкологическое заболевание.
Примером является диагностика рака предстательной железы (РПЖ) с помощью PCA3.
РПЖ является одним из наиболее распространенных злокачественных заболеваний у мужчин. Золотым стандартом диагностики РПЖ является биопсия предстательной железы с последующим гистопатологическим подтверждением диагноза. Биопсия представляет собой забор ткани для последующего его исследования. Ввиду своей инвазивности данный метод может привести к некоторым осложнениям, таким как дискомфорт, гематурия (кровь в моче), затрудненное мочеиспускание и присоединение инфекции. Одним из основных показаний для проведения биопсии является повышение уровня простатспецифического антигена (ПСА). Однако уровень ПСА может повышаться не только при раке предстательной железы, но и при ее воспалении, доброкачественной гиперплазии, инфекции мочевыводящих путей и простатите. Это обусловлено тем, что ПСА является не специфическим для опухоли маркером, а маркером, специфичным для органа. Следовательно, иногда проведение биопсии может быть ненужной, и можно избежать определённых осложнений, связанных с хирургической процедурой. Кроме того, в ряде случаев могут назначаться ненужные повторные биопсии. Дело в том, что точность биопсии зависит от количества взятых образцов ткани и мест, из которых они взяты. Можно при заборе материала «не попасть» в изменённую опухолевую ткань, и тогда патоморфолог под микроскопом не увидит опухолевые клетки. Поэтому отрицательный результат первичной биопсии может оставить у врача сомнения, действительно ли рака нет или его «пропустили». Эта обеспокоенность может стать причиной назначения дополнительных биопсий, которые также могут привести к неприятным осложнениям. При этом в некоторых случаях РПЖ не происходит повышения уровня ПСА, и, соответственно, опираясь только на этот маркер, можно «пропустить» рак.
PCA3 является одним из ключевых маркеров в диагностике РПЖ. Определение данного маркера проводится в первой собранной порции мочи после пальцевого ректального массажа. Данный маркер является опухолевоспецифичным. В низких количествах данная РНК выделяется и нормальной тканью простаты, однако ее присутствие в повышенных количествах обусловлено в 95% случаях раком предстательной железы. Ни воспаление, ни доброкачественная гиперплазия не влияют на уровень PCA3. Использование данного маркера позволит с более высокой точностью определять показание к проведению биопсии предстательной железы. Кроме того, определение PCA3 позволяет избежать ненужной повторной биопсии.
Таким образом, молекулярно-генетическое тестирование предоставляет большие возможности врачу для диагностики, лечения, профилактики, скрининга, мониторинга развития онкологических заболеваний.
